Pernahkah kamu terpukau melihat warna-warni indah pada perhiasan emas, perak, atau bahkan pigmen cat yang mencolok? Warna-warna itu, seringkali, adalah hasil "ulah" unsur transisi. Tapi, mengapa unsur transisi memiliki warna menarik? Bukankah semuanya hanya atom dan elektron? Nah, di artikel ini, kita akan menyelami dunia kimia yang mempesona untuk mengungkap rahasia di balik warna-warni cantik ini. Kita akan membahas teori-teori yang mendasari, faktor-faktor yang memengaruhi, dan contoh-contoh nyata yang akan membuatmu semakin takjub.
Mengenal Unsur Transisi: Lebih dari Sekadar Logam
Unsur transisi, terletak di blok-d tabel periodik, adalah kelompok unsur yang terkenal dengan sifat-sifat uniknya. Mereka adalah logam yang keras, konduktor yang baik, dan seringkali, katalis yang hebat.
Apa Itu Unsur Transisi?
Unsur transisi adalah unsur-unsur yang memiliki orbital d yang tidak terisi penuh (atau dapat membentuk kation dengan orbital d yang tidak terisi penuh). Hal ini berbeda dengan unsur-unsur golongan utama yang elektron valensinya hanya mengisi orbital s dan p.
Sifat-Sifat Khas Unsur Transisi
Selain sifat-sifat logam yang umum, unsur transisi memiliki beberapa karakteristik yang membedakannya:
- Beberapa bilangan oksidasi: Mereka dapat membentuk senyawa dengan berbagai bilangan oksidasi, memungkinkan variasi dalam ikatan kimia.
- Pembentukan ion kompleks: Mereka cenderung membentuk ion kompleks dengan ligan (molekul atau ion yang mengelilingi ion logam pusat).
- Sifat paramagnetik: Banyak ion transisi memiliki elektron yang tidak berpasangan, sehingga bersifat paramagnetik (tertarik oleh medan magnet).
- Warna: Inilah fokus utama kita! Banyak senyawa transisi memiliki warna yang cerah dan menarik.
Rahasia di Balik Warna: Teori Orbital d dan Transisi d-d
Inilah inti dari pertanyaan mengapa unsur transisi memiliki warna menarik. Jawabannya terletak pada konfigurasi elektron dan bagaimana mereka berinteraksi dengan cahaya.
Konfigurasi Elektron dan Orbital d
Unsur transisi memiliki elektron valensi di orbital d. Orbital d ini memiliki lima orientasi spasial yang berbeda, yang kita sebut dxy, dxz, dyz, dx2-y2, dan dz2. Dalam atom yang terisolasi, semua orbital d ini memiliki energi yang sama (degenerasi).
Pemisahan Orbital d oleh Ligan
Ketika ion transisi membentuk kompleks dengan ligan, simetri di sekitar ion logam berubah. Ligan, yang bermuatan negatif atau memiliki pasangan elektron bebas, berinteraksi dengan orbital d ion logam. Interaksi ini tidak seragam; beberapa orbital d akan berinteraksi lebih kuat daripada yang lain, menyebabkan pemisahan energi orbital d. Orbital d yang lebih berinteraksi dengan ligan akan memiliki energi yang lebih tinggi.
Transisi d-d dan Absorpsi Cahaya
Pemisahan energi orbital d menciptakan celah energi. Ketika cahaya dengan energi yang sesuai (sesuai dengan celah energi ini) mengenai kompleks transisi, elektron dapat tereksitasi dari orbital d dengan energi lebih rendah ke orbital d dengan energi lebih tinggi. Proses ini disebut transisi d-d.
Energi cahaya yang diserap tergantung pada besarnya pemisahan energi orbital d. Cahaya yang tidak diserap akan dipantulkan atau ditransmisikan, dan inilah yang kita lihat sebagai warna kompleks. Sebagai contoh, jika sebuah kompleks menyerap cahaya kuning dan hijau, kita akan melihatnya berwarna ungu (campuran warna merah dan biru).
Faktor-Faktor yang Mempengaruhi Warna Unsur Transisi
Warna senyawa transisi tidak hanya ditentukan oleh jenis logamnya, tetapi juga oleh beberapa faktor lain.
Jenis Logam Transisi
Setiap logam transisi memiliki konfigurasi elektron yang unik, yang mempengaruhi pemisahan energi orbital d dan, akibatnya, warna yang dihasilkan. Misalnya, ion tembaga (Cu2+) sering menghasilkan warna biru atau hijau, sedangkan ion kobalt (Co2+) cenderung menghasilkan warna merah muda atau biru.
Ligan yang Terikat
Ligan memainkan peran penting dalam menentukan besarnya pemisahan energi orbital d. Ligan yang berbeda memiliki kekuatan yang berbeda dalam berinteraksi dengan orbital d. Urutan kekuatan ligan disebut sebagai deret spektrokimia.
- Ligan Kuat: Ligan kuat (seperti CN– dan CO) menyebabkan pemisahan energi orbital d yang besar, yang berarti energi cahaya yang diserap lebih tinggi (panjang gelombang lebih pendek, seperti biru atau ungu).
- Ligan Lemah: Ligan lemah (seperti Cl– dan H2O) menyebabkan pemisahan energi orbital d yang kecil, yang berarti energi cahaya yang diserap lebih rendah (panjang gelombang lebih panjang, seperti merah atau kuning).
Geometri Kompleks
Geometri kompleks (misalnya, tetrahedral, oktahedral, atau planar persegi) juga memengaruhi pemisahan energi orbital d. Geometri yang berbeda akan menghasilkan pola interaksi yang berbeda antara ligan dan orbital d, yang menghasilkan pemisahan energi yang berbeda.
Bilangan Oksidasi
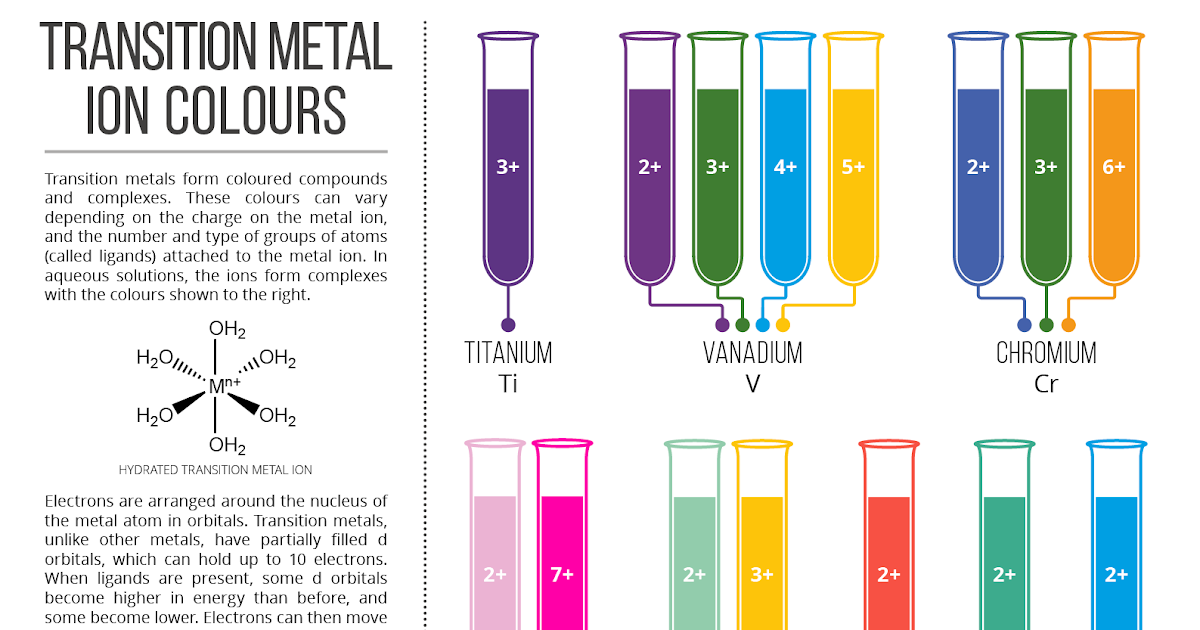
Bilangan oksidasi ion logam transisi memengaruhi jumlah elektron d dan, akibatnya, transisi d-d yang mungkin terjadi. Perubahan bilangan oksidasi dapat mengubah warna kompleks. Misalnya, ion vanadium (V) memiliki berbagai warna tergantung pada bilangan oksidasinya: V2+ (ungu), V3+ (hijau), VO2+ (biru), dan VO43- (kuning).
Contoh Nyata Warna Unsur Transisi
Warna-warni unsur transisi dapat kita temukan di berbagai tempat di sekitar kita.
Perhiasan
- Emas: Warna kuning keemasan emas (Au) disebabkan oleh transisi elektron, meskipun sedikit berbeda dari transisi d-d yang dibahas sebelumnya.
- Perak: Perak (Ag) memantulkan semua warna cahaya tampak, sehingga terlihat putih mengkilap.
- Tembaga: Tembaga (Cu) oksida menghasilkan warna hijau pada Patung Liberty.
- Batu permata: Banyak batu permata mendapatkan warnanya dari ion logam transisi. Misalnya, zamrud berwarna hijau karena adanya ion kromium (Cr3+), dan rubi berwarna merah karena adanya ion kromium (Cr3+).
Pigmen
- Cat: Pigmen cat sering kali mengandung senyawa transisi. Misalnya, biru prusia mengandung besi (Fe), dan kuning kadmium mengandung kadmium (Cd).
- Keramik: Senyawa transisi juga digunakan untuk mewarnai keramik. Kobalt (Co) oksida menghasilkan warna biru yang indah pada keramik.
Biologi
- Hemoglobin: Hemoglobin dalam darah kita mengandung besi (Fe), yang bertanggung jawab atas warna merah darah. Besi mengikat oksigen, dan interaksi ini mengubah warna hemoglobin.
- Klorofil: Klorofil dalam tumbuhan mengandung magnesium (Mg), yang bertanggung jawab atas warna hijau tumbuhan.
Aplikasi Warna Unsur Transisi
Warna-warni unsur transisi tidak hanya indah, tetapi juga memiliki berbagai aplikasi praktis.
Katalisis
Banyak senyawa transisi digunakan sebagai katalis dalam berbagai reaksi kimia. Sifat-sifat unik mereka, termasuk kemampuan untuk membentuk berbagai bilangan oksidasi dan ion kompleks, memungkinkan mereka untuk memfasilitasi reaksi kimia. Dalam beberapa kasus, perubahan warna senyawa transisi dapat digunakan untuk memantau kemajuan reaksi.
Deteksi Ion Logam
Warna yang dihasilkan oleh ion logam transisi dapat digunakan untuk mendeteksi keberadaan dan konsentrasi ion-ion ini dalam larutan. Spektrofotometri, teknik yang mengukur absorpsi cahaya oleh suatu zat, sering digunakan untuk tujuan ini.
Tampilan Warna
Senyawa transisi digunakan dalam berbagai teknologi tampilan warna, seperti layar televisi, monitor komputer, dan layar ponsel. Fosfor yang memancarkan cahaya dalam berbagai warna sering kali mengandung senyawa transisi.
Kesimpulan
Jadi, mengapa unsur transisi memiliki warna menarik? Jawabannya terletak pada kombinasi konfigurasi elektron unik mereka, kemampuan untuk membentuk ion kompleks, dan fenomena transisi d-d. Pemisahan energi orbital d oleh ligan memungkinkan elektron untuk menyerap cahaya tampak, menghasilkan warna-warni yang kita lihat. Faktor-faktor seperti jenis logam, ligan, geometri kompleks, dan bilangan oksidasi semuanya memengaruhi warna yang dihasilkan. Warna-warni unsur transisi tidak hanya memanjakan mata, tetapi juga memiliki berbagai aplikasi praktis dalam berbagai bidang, mulai dari perhiasan dan pigmen hingga katalisis dan teknologi tampilan warna. Bagaimana menurutmu? Warna senyawa transisi mana yang paling memukau? Bagikan pengalamanmu!
FAQ
Berikut adalah beberapa pertanyaan umum tentang warna unsur transisi:
1. Mengapa tidak semua unsur transisi berwarna?
Tidak semua unsur transisi memiliki senyawa berwarna. Beberapa unsur transisi memiliki konfigurasi d0 atau d10, yang berarti tidak ada elektron d yang dapat tereksitasi dalam rentang energi cahaya tampak. Senyawa dari unsur-unsur ini biasanya tidak berwarna.
2. Apakah warna senyawa transisi selalu sama?
Tidak, warna senyawa transisi dapat bervariasi tergantung pada faktor-faktor seperti ligan yang terikat, geometri kompleks, dan bilangan oksidasi ion logam.
3. Bagaimana cara memprediksi warna senyawa transisi?
Meskipun sulit untuk memprediksi warna secara akurat tanpa perhitungan yang rumit, kita dapat menggunakan deret spektrokimia dan pengetahuan tentang geometri kompleks untuk memperkirakan warna yang mungkin. Ligan yang lebih kuat cenderung menghasilkan warna dengan panjang gelombang yang lebih pendek (biru atau ungu), sementara ligan yang lebih lemah cenderung menghasilkan warna dengan panjang gelombang yang lebih panjang (merah atau kuning).