Pernah nggak sih, lagi belajar fisika modern terus tiba-tiba ketemu istilah "spektrum atom hidrogen" dan langsung merasa pusing? Tenang, kamu nggak sendirian! Banyak kok yang merasa kesulitan memahami konsep ini. Tapi jangan khawatir, di artikel ini kita akan membahas panduan lengkap memahami spektrum atom hidrogen dengan bahasa yang santai dan mudah dimengerti. Siap? Yuk, mulai!
Apa Itu Spektrum Atom Hidrogen?
Spektrum atom hidrogen adalah pola unik dari panjang gelombang cahaya yang dipancarkan atau diserap oleh atom hidrogen. Pola ini nggak sembarangan lho! Dia menyimpan banyak informasi penting tentang struktur atom dan energi yang terlibat di dalamnya. Bayangkan spektrum ini seperti sidik jari atom hidrogen, unik dan nggak bisa ditiru.
Mengapa Spektrum Atom Hidrogen Penting?
Spektrum atom hidrogen punya peran krusial dalam perkembangan fisika modern.
- Bukti Kuantisasi Energi: Spektrum ini adalah bukti kuat bahwa energi dalam atom terkuantisasi, artinya energi hanya bisa berada pada tingkat-tingkat tertentu, bukan nilai kontinu.
- Memvalidasi Teori Atom: Spektrum hidrogen menjadi landasan untuk mengembangkan dan memvalidasi teori atom, khususnya model atom Bohr dan model atom modern berdasarkan mekanika kuantum.
- Analisis Komposisi Bintang: Dengan menganalisis spektrum cahaya dari bintang, kita bisa mengetahui komposisi bintang tersebut. Keberadaan hidrogen dalam bintang bisa dideteksi dari spektrumnya.
Sejarah Penemuan Spektrum Atom Hidrogen
Penemuan spektrum atom hidrogen nggak terjadi dalam semalam. Ini adalah hasil kerja keras dan observasi teliti dari banyak ilmuwan selama bertahun-tahun.
Observasi Awal dan Garis Spektral
Pada abad ke-19, para ilmuwan mulai mengamati spektrum cahaya yang dipancarkan oleh berbagai unsur, termasuk hidrogen. Mereka menemukan bahwa spektrum hidrogen terdiri dari serangkaian garis terang pada panjang gelombang tertentu, yang disebut garis spektral.
Rumus Empiris Balmer
Pada tahun 1885, Johann Balmer, seorang guru matematika Swiss, berhasil menemukan rumus empiris yang cocok dengan panjang gelombang garis spektral hidrogen yang terlihat (deret Balmer). Rumus Balmer ini menjadi titik awal penting untuk memahami struktur spektrum hidrogen.
Penjelasan Teoretis oleh Bohr
Pada tahun 1913, Niels Bohr, seorang fisikawan Denmark, memberikan penjelasan teoretis yang revolusioner tentang spektrum atom hidrogen. Bohr mengusulkan model atom di mana elektron hanya bisa berada pada orbit-orbit tertentu dengan energi yang terkuantisasi. Transisi elektron antar orbit ini menghasilkan emisi atau absorpsi foton dengan energi yang sesuai dengan perbedaan energi antara orbit. Model atom Bohr berhasil menjelaskan rumus Balmer dan spektrum hidrogen secara keseluruhan.
Deret Spektral Atom Hidrogen
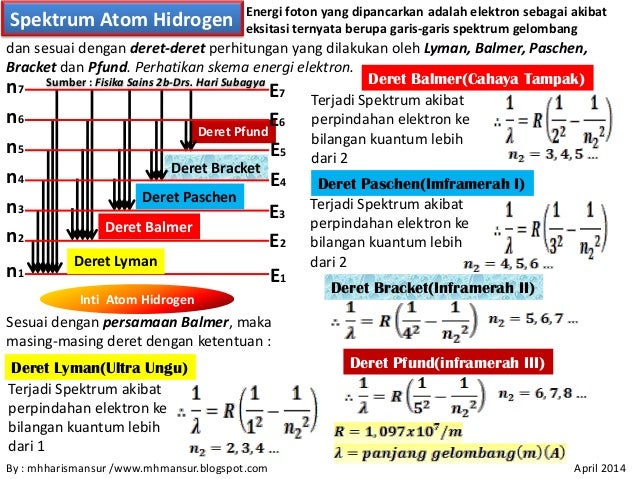
Spektrum atom hidrogen terdiri dari beberapa deret spektral, masing-masing sesuai dengan transisi elektron ke tingkat energi tertentu.
Deret Lyman
Deret Lyman terletak pada daerah ultraviolet spektrum elektromagnetik. Deret ini dihasilkan oleh transisi elektron dari tingkat energi yang lebih tinggi ke tingkat energi dasar (n=1).
Deret Balmer
Deret Balmer terletak pada daerah видимого света spektrum elektromagnetik. Deret ini dihasilkan oleh transisi elektron dari tingkat energi yang lebih tinggi ke tingkat energi n=2. Deret Balmer adalah deret pertama yang berhasil dijelaskan secara matematis oleh Balmer.
Deret Paschen
Deret Paschen terletak pada daerah inframerah spektrum elektromagnetik. Deret ini dihasilkan oleh transisi elektron dari tingkat energi yang lebih tinggi ke tingkat energi n=3.
Deret Brackett
Deret Brackett terletak pada daerah inframerah spektrum elektromagnetik. Deret ini dihasilkan oleh transisi elektron dari tingkat energi yang lebih tinggi ke tingkat energi n=4.
Deret Pfund
Deret Pfund terletak pada daerah inframerah spektrum elektromagnetik. Deret ini dihasilkan oleh transisi elektron dari tingkat energi yang lebih tinggi ke tingkat energi n=5.
Bagaimana Spektrum Atom Hidrogen Terbentuk?
Pembentukan spektrum atom hidrogen melibatkan proses eksitasi dan deeksitasi elektron.
Eksitasi Elektron
Ketika atom hidrogen menyerap energi (misalnya, dari panas atau cahaya), elektron dapat meloncat dari tingkat energi yang lebih rendah ke tingkat energi yang lebih tinggi. Proses ini disebut eksitasi.
Deeksitasi Elektron dan Emisi Foton
Elektron yang berada pada tingkat energi yang lebih tinggi tidak stabil dan cenderung kembali ke tingkat energi yang lebih rendah. Ketika elektron kembali ke tingkat energi yang lebih rendah, ia melepaskan energi dalam bentuk foton (partikel cahaya). Energi foton ini sama dengan perbedaan energi antara kedua tingkat energi. Panjang gelombang foton ini menentukan warna garis spektral yang terlihat.
Hubungan Antara Energi, Frekuensi, dan Panjang Gelombang
Energi (E) foton, frekuensi (ν), dan panjang gelombang (λ) memiliki hubungan yang erat:
- E = hν, di mana h adalah konstanta Planck.
- c = λν, di mana c adalah kecepatan cahaya.
Dari kedua persamaan ini, kita bisa melihat bahwa energi foton berbanding terbalik dengan panjang gelombangnya. Artinya, foton dengan energi tinggi memiliki panjang gelombang pendek (misalnya, ultraviolet), sedangkan foton dengan energi rendah memiliki panjang gelombang panjang (misalnya, inframerah).
Model Atom Bohr dan Spektrum Hidrogen
Model atom Bohr adalah model atom pertama yang berhasil menjelaskan spektrum atom hidrogen secara kuantitatif.
Postulat Bohr
Model atom Bohr didasarkan pada beberapa postulat:
- Elektron hanya dapat berada pada orbit-orbit tertentu di sekitar inti atom.
- Setiap orbit memiliki energi yang terkuantisasi.
- Elektron dapat bertransisi dari satu orbit ke orbit lain dengan menyerap atau memancarkan foton.
Energi Tingkat Energi dalam Model Bohr
Energi tingkat energi ke-n dalam model Bohr diberikan oleh persamaan:
En = -13.6 eV / n2
Di mana:
- En adalah energi tingkat energi ke-n.
- n adalah bilangan kuantum utama (n = 1, 2, 3, …).
- -13.6 eV adalah energi ionisasi hidrogen.
Kekurangan Model Bohr
Meskipun berhasil menjelaskan spektrum hidrogen, model atom Bohr memiliki beberapa kekurangan:
- Tidak dapat menjelaskan spektrum atom yang lebih kompleks dengan lebih dari satu elektron.
- Bertentangan dengan prinsip ketidakpastian Heisenberg.
Mekanika Kuantum dan Spektrum Hidrogen
Mekanika kuantum memberikan deskripsi yang lebih akurat tentang struktur atom dan spektrum atom hidrogen.
Persamaan Schrödinger
Persamaan Schrödinger adalah persamaan fundamental dalam mekanika kuantum yang menggambarkan perilaku partikel mikroskopis, termasuk elektron dalam atom.
Orbital Atom
Dalam mekanika kuantum, elektron tidak bergerak dalam orbit yang pasti, melainkan berada dalam orbital atom. Orbital atom adalah daerah ruang di sekitar inti atom di mana elektron memiliki probabilitas tertinggi untuk ditemukan.
Bilangan Kuantum
Setiap orbital atom ditandai oleh empat bilangan kuantum:
- Bilangan Kuantum Utama (n): Menentukan tingkat energi elektron (n = 1, 2, 3, …).
- Bilangan Kuantum Azimuthal (l): Menentukan bentuk orbital (l = 0, 1, 2, …, n-1). l = 0 adalah orbital s (bentuk bola), l = 1 adalah orbital p (bentuk dumbbell), l = 2 adalah orbital d, dan seterusnya.
- Bilangan Kuantum Magnetik (ml): Menentukan orientasi orbital dalam ruang (ml = -l, -l+1, …, 0, …, l-1, l).
- Bilangan Kuantum Spin (ms): Menentukan spin elektron (ms = +1/2 atau -1/2).
Penjelasan Spektrum Hidrogen dengan Mekanika Kuantum
Mekanika kuantum berhasil menjelaskan spektrum hidrogen dengan sangat akurat. Transisi elektron antar orbital atom menghasilkan emisi atau absorpsi foton dengan energi yang sesuai dengan perbedaan energi antara orbital. Perhitungan menggunakan persamaan Schrödinger memberikan hasil yang sangat sesuai dengan hasil eksperimen.
Aplikasi Spektrum Atom Hidrogen
Spektrum atom hidrogen memiliki banyak aplikasi penting dalam berbagai bidang.
Astrofisika
Seperti yang sudah disinggung, spektrum hidrogen digunakan untuk menganalisis komposisi bintang dan galaksi. Dengan menganalisis garis spektral hidrogen dalam cahaya dari bintang, para astronom dapat menentukan suhu, kerapatan, dan kecepatan bintang tersebut.
Kimia Analitik
Spektrum hidrogen dapat digunakan untuk mendeteksi keberadaan hidrogen dalam sampel kimia. Teknik spektroskopi atomik memanfaatkan prinsip absorpsi dan emisi cahaya oleh atom untuk mengidentifikasi dan mengukur konsentrasi unsur-unsur dalam sampel.
Fisika Plasma
Spektrum hidrogen digunakan untuk mempelajari sifat-sifat plasma, yaitu gas terionisasi yang sangat panas. Analisis spektrum hidrogen dalam plasma dapat memberikan informasi tentang suhu, kerapatan, dan komposisi plasma.
Kesimpulan
Panduan lengkap memahami spektrum atom hidrogen ini telah membawamu dari konsep dasar hingga aplikasi praktisnya. Kita sudah membahas sejarah penemuan, deret spektral, pembentukan spektrum, model atom Bohr, dan penjelasan mekanika kuantum. Spektrum atom hidrogen bukan hanya sekadar pola garis, tapi jendela menuju pemahaman mendalam tentang struktur atom dan alam semesta. Gimana, sekarang sudah nggak pusing lagi kan? Kalau masih ada pertanyaan, jangan ragu untuk bertanya di kolom komentar! Atau, coba deh ceritakan pengalamanmu belajar tentang spektrum atom hidrogen!
FAQ (Frequently Asked Questions)
1. Apa perbedaan antara spektrum emisi dan spektrum absorpsi?
- Spektrum emisi adalah spektrum yang dihasilkan ketika atom memancarkan cahaya. Ini terjadi ketika elektron bertransisi dari tingkat energi yang lebih tinggi ke tingkat energi yang lebih rendah.
- Spektrum absorpsi adalah spektrum yang dihasilkan ketika atom menyerap cahaya. Ini terjadi ketika elektron bertransisi dari tingkat energi yang lebih rendah ke tingkat energi yang lebih tinggi.
2. Mengapa spektrum atom hidrogen diskrit (terdiri dari garis-garis)?
Spektrum atom hidrogen diskrit karena energi dalam atom terkuantisasi. Artinya, elektron hanya dapat berada pada tingkat energi tertentu. Ketika elektron bertransisi antar tingkat energi, ia memancarkan atau menyerap foton dengan energi yang sesuai dengan perbedaan energi antara kedua tingkat energi. Karena energi foton terkuantisasi, maka panjang gelombang cahaya yang dipancarkan atau diserap juga terkuantisasi, menghasilkan garis-garis spektral yang diskrit.
3. Apa hubungan antara spektrum atom hidrogen dengan teknologi modern?
Spektrum atom hidrogen memiliki banyak aplikasi dalam teknologi modern, seperti dalam pengembangan laser, spektroskopi atomik, dan analisis plasma. Pemahaman tentang spektrum hidrogen juga penting dalam penelitian energi terbarukan, khususnya dalam pengembangan sel surya.