Pernah nggak sih kamu bertanya-tanya, kok bisa ya kita memprediksi perubahan energi dalam reaksi kimia yang rumit, padahal kita nggak ngelihat langsung prosesnya? Kayak sulap aja gitu! Nah, di sinilah peran penting Hukum Hess: Prinsip Penjumlahan Energi Reaksi Kimia. Ini bukan sihir, tapi prinsip ilmiah yang keren banget!
Dalam artikel ini, kita akan mengupas tuntas Hukum Hess. Kita akan belajar bagaimana prinsip ini bekerja, kenapa sangat penting dalam dunia kimia, dan bagaimana cara menggunakannya untuk memecahkan berbagai masalah perhitungan energi. Jadi, siap untuk menyelami dunia termokimia yang menakjubkan? Yuk, lanjut!
Memahami Dasar Hukum Hess: Apa Itu dan Mengapa Penting?
Hukum Hess, atau dikenal juga sebagai Hukum Penjumlahan Panas, menyatakan bahwa perubahan entalpi (ΔH) untuk suatu reaksi kimia hanya bergantung pada keadaan awal dan keadaan akhir reaksi, dan tidak bergantung pada jalur atau tahapan reaksi. Sederhananya, mau reaksi itu terjadi dalam satu langkah atau seribu langkah, perubahan energinya tetap sama.
Kenapa Hukum Hess Begitu Penting?
Bayangkan kamu mau mendaki gunung. Mau lewat jalur yang panjang berkelok-kelok atau jalur curam yang langsung naik, ketinggian yang kamu capai tetap sama kan? Nah, Hukum Hess itu kayak gitu juga.
- Memprediksi Perubahan Entalpi: Hukum Hess memungkinkan kita menghitung perubahan entalpi suatu reaksi, bahkan jika reaksi tersebut sulit atau tidak mungkin diukur secara langsung.
- Menyederhanakan Perhitungan: Dengan Hukum Hess, kita bisa memecah reaksi kompleks menjadi serangkaian reaksi yang lebih sederhana dan diketahui perubahan entalpinya.
- Desain Reaksi Kimia: Membantu para ilmuwan dalam merancang dan mengoptimalkan reaksi kimia, khususnya dalam industri dan penelitian.
Entalpi: Apa Hubungannya dengan Hukum Hess?
Entalpi (H) adalah ukuran kandungan panas suatu sistem pada tekanan konstan. Perubahan entalpi (ΔH) merupakan panas yang dilepaskan atau diserap selama reaksi kimia pada tekanan konstan. ΔH ini adalah kunci utama dalam Hukum Hess.
Perubahan entalpi (ΔH) bisa bernilai positif (reaksi endotermik, menyerap panas) atau negatif (reaksi eksotermik, melepaskan panas). Hukum Hess memungkinkan kita menghitung ΔH suatu reaksi dengan menjumlahkan ΔH dari setiap tahapannya.
Cara Kerja Hukum Hess: Langkah Demi Langkah
Sekarang, mari kita bedah bagaimana Hukum Hess bekerja dalam praktik. Ini bukan rumus yang menakutkan, kok. Justru sangat logis dan mudah dipahami.
Siklus Hess: Visualisasi yang Memudahkan
Siklus Hess adalah diagram yang memvisualisasikan perubahan entalpi dalam suatu reaksi. Diagram ini membantu kita melihat hubungan antara reaksi utama dengan reaksi-reaksi tahapan yang menyusunnya.
Bayangkan siklus Hess seperti peta yang menunjukkan berbagai rute dari titik A ke titik B. Setiap rute memiliki perubahan energi sendiri-sendiri, tapi total perubahannya tetap sama.
Menggunakan Persamaan Termokimia untuk Hukum Hess
Persamaan termokimia adalah persamaan kimia yang menyertakan perubahan entalpi (ΔH). Dengan persamaan ini, kita bisa memanipulasi reaksi-reaksi kimia seperti aljabar biasa.
- Membalik Reaksi: Jika kita membalik suatu reaksi, tanda ΔH-nya juga berubah. Misalnya, jika reaksi A → B memiliki ΔH = +X kJ, maka reaksi B → A memiliki ΔH = -X kJ.
- Mengalikan Reaksi: Jika kita mengalikan suatu reaksi dengan suatu faktor, ΔH-nya juga dikalikan dengan faktor yang sama. Misalnya, jika reaksi A → B memiliki ΔH = +X kJ, maka reaksi 2A → 2B memiliki ΔH = +2X kJ.
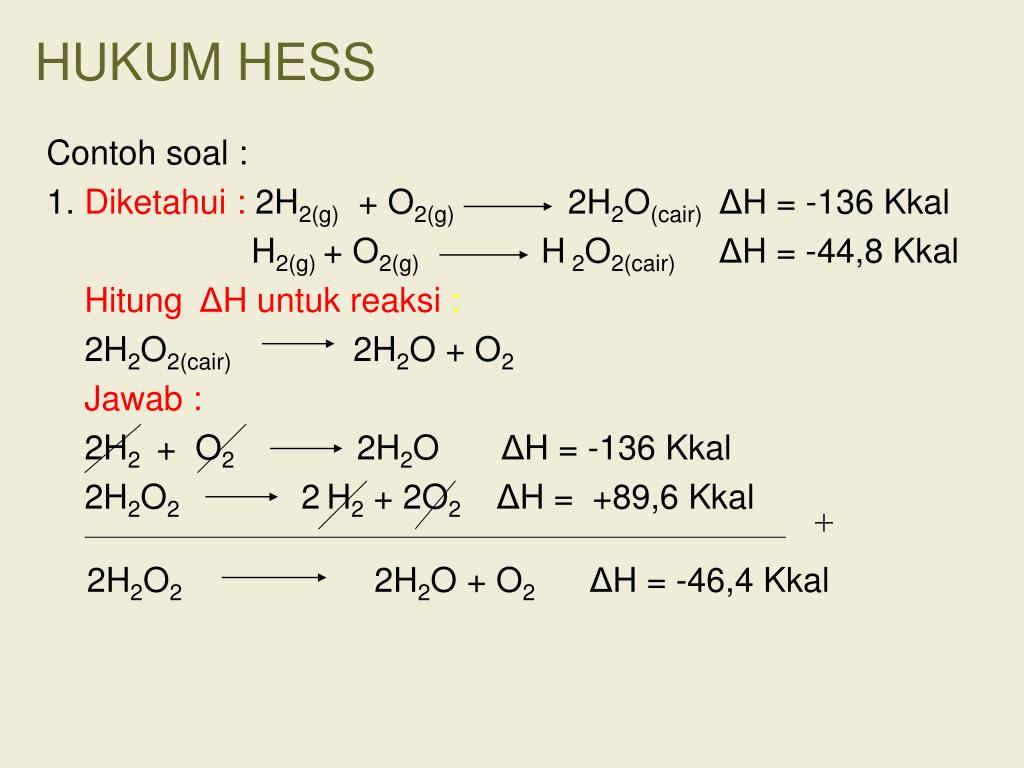
Contoh Soal: Menghitung Perubahan Entalpi dengan Hukum Hess
Mari kita lihat contoh soal sederhana:
Hitung ΔH untuk reaksi: C(s) + O2(g) → CO2(g)
Diketahui:
- C(s) + ½ O2(g) → CO(g) ΔH1 = -110.5 kJ
- CO(g) + ½ O2(g) → CO2(g) ΔH2 = -283.0 kJ
Penyelesaian:
Kita bisa melihat bahwa jika kita menjumlahkan kedua reaksi tersebut, kita akan mendapatkan reaksi yang kita inginkan.
C(s) + ½ O2(g) → CO(g) ΔH1 = -110.5 kJ
CO(g) + ½ O2(g) → CO2(g) ΔH2 = -283.0 kJ
————————————————– +
C(s) + O2(g) → CO2(g) ΔH = ΔH1 + ΔH2 = -110.5 kJ + (-283.0 kJ) = -393.5 kJ
Jadi, ΔH untuk reaksi C(s) + O2(g) → CO2(g) adalah -393.5 kJ.
Penerapan Hukum Hess dalam Kehidupan Sehari-hari dan Industri
Hukum Hess bukan cuma teori di buku pelajaran. Prinsip ini memiliki aplikasi yang luas dalam berbagai bidang.
Industri Kimia: Optimasi Proses Produksi
Dalam industri kimia, Hukum Hess digunakan untuk menghitung perubahan entalpi reaksi dalam proses produksi berbagai bahan kimia. Hal ini membantu para insinyur untuk:
- Merancang reaktor: Memastikan reaktor dapat menangani panas yang dilepaskan atau diserap selama reaksi.
- Mengoptimalkan kondisi reaksi: Mencari kondisi yang paling efisien dan hemat energi.
- Memprediksi hasil reaksi: Memperkirakan jumlah produk yang dihasilkan berdasarkan perubahan entalpi.
Penelitian Ilmiah: Memahami Reaksi Kompleks
Dalam penelitian, Hukum Hess membantu para ilmuwan untuk memahami reaksi-reaksi kompleks yang sulit dipelajari secara langsung. Misalnya:
- Mempelajari mekanisme reaksi: Dengan memecah reaksi menjadi tahapan-tahapan yang lebih sederhana, para ilmuwan dapat memahami bagaimana reaksi tersebut berlangsung.
- Mengembangkan katalis: Hukum Hess dapat digunakan untuk mengevaluasi efektivitas berbagai katalis dalam mempercepat reaksi.
- Menjelaskan fenomena alam: Hukum Hess dapat digunakan untuk menjelaskan perubahan energi dalam proses-proses alami seperti fotosintesis dan respirasi.
Energi Terbarukan: Pengembangan Bahan Bakar Alternatif
Hukum Hess juga berperan penting dalam pengembangan energi terbarukan, khususnya dalam:
- Penelitian bahan bakar hidrogen: Memahami perubahan entalpi dalam reaksi pembentukan dan pembakaran hidrogen.
- Pengembangan sel surya: Mengoptimalkan efisiensi sel surya dengan memahami transfer energi dalam proses fotosintesis buatan.
- Produksi biofuel: Menghitung energi yang dihasilkan dari pembakaran biofuel dan membandingkannya dengan bahan bakar fosil.
Tips dan Trik Menguasai Hukum Hess
Supaya kamu makin jago dalam menggunakan Hukum Hess, berikut beberapa tips dan trik yang bisa kamu terapkan:
- Pahami konsep dasar entalpi: Pastikan kamu benar-benar mengerti apa itu entalpi dan bagaimana perubahannya (ΔH) berkaitan dengan reaksi kimia.
- Latihan soal sebanyak mungkin: Semakin banyak soal yang kamu kerjakan, semakin terbiasa kamu dengan berbagai jenis soal dan cara penyelesaiannya.
- Gunakan siklus Hess untuk visualisasi: Siklus Hess membantu kamu melihat hubungan antara reaksi-reaksi dan mempermudah perhitungan.
- Perhatikan tanda ΔH: Pastikan kamu selalu memperhatikan tanda positif atau negatif pada ΔH, karena ini menentukan apakah reaksi tersebut endotermik atau eksotermik.
- Manipulasi persamaan termokimia dengan hati-hati: Ingat, jika kamu membalik reaksi, tanda ΔH-nya juga berubah. Jika kamu mengalikan reaksi dengan suatu faktor, ΔH-nya juga dikalikan dengan faktor yang sama.
- Gunakan data standar: Jika kamu tidak diberikan data ΔH untuk suatu reaksi, kamu bisa menggunakan data entalpi pembentukan standar (ΔHf°) yang biasanya tersedia dalam tabel.
Kesimpulan
Hukum Hess: Prinsip Penjumlahan Energi Reaksi Kimia adalah konsep fundamental dalam termokimia yang memungkinkan kita untuk menghitung perubahan entalpi suatu reaksi tanpa harus mengukur langsung. Dengan memahami prinsip ini, kita dapat memprediksi, menyederhanakan, dan mengoptimalkan berbagai proses kimia dalam kehidupan sehari-hari dan industri.
Semoga artikel ini membantumu memahami Hukum Hess dengan lebih baik. Jangan ragu untuk bereksperimen dengan soal-soal latihan dan eksplorasi lebih lanjut. Apakah kamu punya pengalaman menarik terkait Hukum Hess? Yuk, berbagi di kolom komentar!
FAQ (Frequently Asked Questions)
Berikut adalah beberapa pertanyaan umum tentang Hukum Hess:
1. Apa perbedaan antara entalpi pembentukan standar (ΔHf°) dan entalpi reaksi standar (ΔHr°)?
- Entalpi pembentukan standar (ΔHf°) adalah perubahan entalpi ketika satu mol suatu senyawa terbentuk dari unsur-unsurnya dalam keadaan standar (298 K dan 1 atm).
- Entalpi reaksi standar (ΔHr°) adalah perubahan entalpi untuk suatu reaksi yang berlangsung dalam keadaan standar. ΔHr° dapat dihitung menggunakan ΔHf° dari reaktan dan produk dengan rumus: ΔHr° = ΣΔHf°(produk) – ΣΔHf°(reaktan).
2. Apakah Hukum Hess berlaku untuk reaksi yang tidak berlangsung pada tekanan konstan?
Hukum Hess berlaku untuk reaksi yang berlangsung pada tekanan konstan. Jika tekanan tidak konstan, perubahan entalpi tidak sama dengan panas reaksi.
3. Bagaimana jika saya tidak memiliki data ΔH untuk semua tahapan reaksi?
Jika kamu tidak memiliki data ΔH untuk semua tahapan reaksi, kamu bisa menggunakan data entalpi pembentukan standar (ΔHf°) untuk menghitung ΔH reaksi menggunakan rumus: ΔHr° = ΣΔHf°(produk) – ΣΔHf°(reaktan). Pastikan kamu memiliki data ΔHf° untuk semua reaktan dan produk.