Pernahkah Anda bertanya-tanya mengapa es batu bisa mendinginkan minuman Anda? Atau mengapa api terasa panas? Jawabannya terletak pada perubahan energi yang terjadi di sekitar kita. Nah, di sinilah termokimia: studi perubahan energi dalam reaksi memegang peranan penting. Kita akan menyelami dunia energi yang tersembunyi di balik setiap perubahan kimia dan fisika. Bersiaplah, karena kita akan mengungkap rahasia panas, dingin, dan segala sesuatu di antaranya!
Mengupas Tuntas Termokimia: Apa Itu Sebenarnya?
Termokimia: studi perubahan energi dalam reaksi adalah cabang ilmu kimia yang fokus pada perubahan panas yang menyertai reaksi kimia dan perubahan fisika. Singkatnya, termokimia mempelajari bagaimana energi berpindah dan berubah bentuk selama proses-proses tersebut berlangsung. Energi ini biasanya dalam bentuk panas, dan kita mengukur perubahannya untuk memahami reaksi tersebut.
Mengapa Termokimia Penting?
Pentingnya termokimia tak bisa dianggap remeh. Ia membantu kita:
- Memprediksi apakah suatu reaksi akan berlangsung spontan atau tidak.
- Menentukan jumlah energi yang dibutuhkan atau dilepaskan dalam suatu proses.
- Merancang proses industri yang lebih efisien dan ramah lingkungan.
- Memahami fenomena alam seperti pembakaran dan fotosintesis.
Tanpa termokimia, kita akan kesulitan memahami dan mengendalikan banyak proses penting dalam kehidupan sehari-hari dan industri.
Konsep Dasar dalam Termokimia yang Wajib Diketahui
Sebelum melangkah lebih jauh, mari kita pahami beberapa konsep dasar yang menjadi fondasi termokimia.
Sistem dan Lingkungan: Dua Entitas Penting
Dalam termokimia, kita selalu berurusan dengan sistem dan lingkungan.
- Sistem adalah bagian dari alam semesta yang menjadi fokus perhatian kita. Ini bisa berupa reaksi kimia dalam tabung reaksi, es batu yang mencair, atau bahkan tubuh manusia.
- Lingkungan adalah segala sesuatu di luar sistem. Lingkungan dapat bertukar energi dengan sistem.
Interaksi antara sistem dan lingkungan inilah yang menghasilkan perubahan energi yang kita amati dalam termokimia.
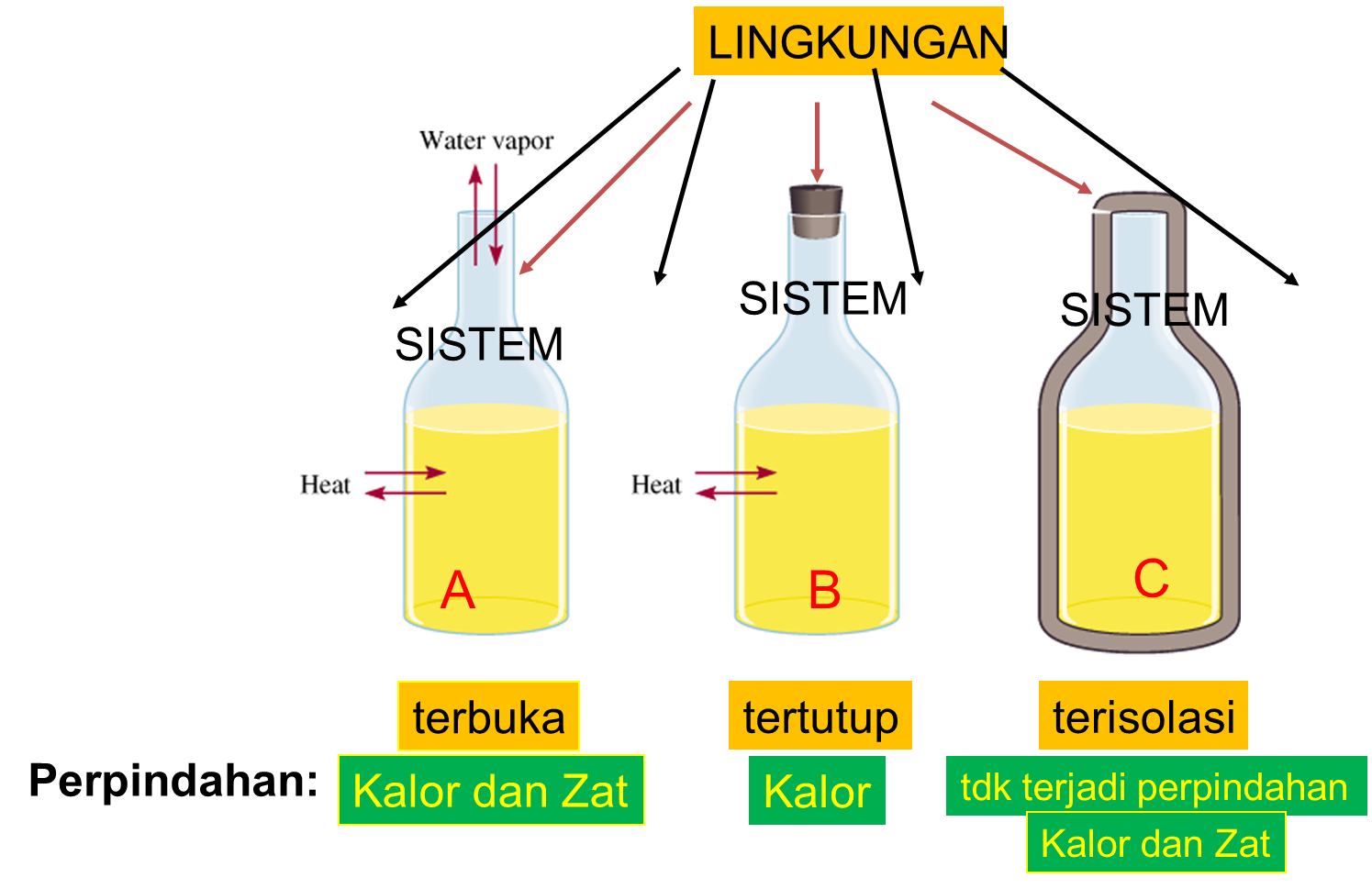
Jenis Sistem Berdasarkan Interaksi dengan Lingkungan
Sistem dapat diklasifikasikan menjadi tiga jenis berdasarkan kemampuannya berinteraksi dengan lingkungan:
- Sistem Terbuka: Sistem yang dapat bertukar energi dan materi dengan lingkungan. Contohnya, secangkir kopi panas yang terbuka.
- Sistem Tertutup: Sistem yang hanya dapat bertukar energi dengan lingkungan, tetapi tidak materi. Contohnya, botol air panas yang tertutup rapat.
- Sistem Terisolasi: Sistem yang tidak dapat bertukar energi maupun materi dengan lingkungan. Contohnya, termos ideal (walaupun dalam praktiknya sulit mencapai sistem terisolasi sempurna).
Entalpi (H): Ukuran Kandungan Panas Sistem
Entalpi adalah fungsi keadaan termodinamika yang menggambarkan kandungan panas suatu sistem pada tekanan konstan. Perubahan entalpi (ΔH) merupakan ukuran panas yang diserap atau dilepaskan selama reaksi kimia atau perubahan fisika pada tekanan konstan.
- Reaksi Eksoterm: Reaksi yang melepaskan panas ke lingkungan (ΔH < 0). Suhu lingkungan akan naik. Contohnya, pembakaran kayu.
- Reaksi Endoterm: Reaksi yang menyerap panas dari lingkungan (ΔH > 0). Suhu lingkungan akan turun. Contohnya, melarutkan garam amonium nitrat dalam air.
Hukum Termodinamika Pertama: Kekekalan Energi
Hukum Termodinamika Pertama menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, melainkan hanya dapat diubah dari satu bentuk ke bentuk lain. Dalam termokimia, hukum ini berarti bahwa total energi dalam sistem dan lingkungan selalu konstan.
ΔU = q + w
Dimana:
- ΔU adalah perubahan energi internal sistem
- q adalah panas yang diserap atau dilepaskan oleh sistem
- w adalah kerja yang dilakukan oleh atau pada sistem
Penerapan Termokimia dalam Kehidupan Sehari-hari
Mungkin Anda berpikir termokimia hanya dipelajari di laboratorium. Padahal, prinsip-prinsip termokimia sangat relevan dalam kehidupan sehari-hari.
Memahami Proses Pembakaran
Pembakaran adalah reaksi kimia eksoterm yang sangat umum. Termokimia membantu kita memahami berapa banyak energi yang dilepaskan saat bahan bakar dibakar. Informasi ini penting untuk:
- Merancang mesin pembakaran yang efisien.
- Mengembangkan bahan bakar alternatif yang lebih ramah lingkungan.
- Memahami bahaya kebakaran dan cara mencegahnya.
Mendesain Sistem Pemanasan dan Pendinginan
Termokimia digunakan untuk merancang sistem pemanas dan pendinginan yang efisien. Contohnya:
- Lemari es: Menggunakan siklus refrigerasi untuk menyerap panas dari dalam lemari es dan melepaskannya ke lingkungan.
- Pemanas ruangan: Memanfaatkan pembakaran bahan bakar atau energi listrik untuk menghasilkan panas.
- AC (Air Conditioner): Mirip dengan lemari es, tetapi digunakan untuk mendinginkan ruangan yang lebih besar.
Memahami Reaksi Kimia dalam Tubuh
Tubuh manusia adalah pabrik kimia yang kompleks. Termokimia membantu kita memahami reaksi kimia yang terjadi dalam tubuh, seperti:
- Metabolisme: Proses pengubahan makanan menjadi energi.
- Respirasi: Proses pengambilan oksigen dan pelepasan karbon dioksida.
- Pencernaan: Proses pemecahan makanan menjadi molekul yang lebih kecil.
Dengan memahami termokimia reaksi-reaksi ini, kita dapat mengembangkan obat-obatan dan terapi yang lebih efektif.
Metode Pengukuran Perubahan Energi dalam Termokimia
Bagaimana kita mengukur perubahan energi dalam reaksi kimia? Ada beberapa metode yang umum digunakan.
Kalorimetri: Mengukur Panas dengan Kalorimeter
Kalorimetri adalah teknik eksperimen untuk mengukur jumlah panas yang diserap atau dilepaskan selama reaksi kimia atau perubahan fisika. Alat yang digunakan disebut kalorimeter.
- Kalorimeter Bom: Digunakan untuk mengukur panas pembakaran. Sistemnya terisolasi sehingga semua panas yang dilepaskan pembakaran diserap oleh kalorimeter.
- Kalorimeter Sederhana: Digunakan untuk mengukur panas reaksi yang terjadi dalam larutan. Biasanya terbuat dari wadah terisolasi seperti gelas styrofoam.
Hukum Hess: Menghitung Perubahan Entalpi secara Tidak Langsung
Hukum Hess menyatakan bahwa perubahan entalpi suatu reaksi kimia hanya bergantung pada keadaan awal dan keadaan akhir, dan tidak bergantung pada jalur reaksi. Dengan kata lain, jika suatu reaksi dapat dipecah menjadi beberapa tahap, perubahan entalpi total adalah jumlah perubahan entalpi dari setiap tahap.
Hukum Hess sangat berguna untuk menghitung perubahan entalpi reaksi yang sulit diukur secara langsung. Kita dapat menggunakan data perubahan entalpi reaksi-reaksi lain yang sudah diketahui untuk menghitung perubahan entalpi reaksi yang kita inginkan.
Menggunakan Data Termokimia Standar
Data termokimia standar, seperti entalpi pembentukan standar (ΔH°f) dan entalpi pembakaran standar (ΔH°c), dapat digunakan untuk menghitung perubahan entalpi reaksi.
- Entalpi Pembentukan Standar (ΔH°f): Perubahan entalpi ketika satu mol suatu senyawa terbentuk dari unsur-unsurnya dalam keadaan standar (298 K dan 1 atm).
- Entalpi Pembakaran Standar (ΔH°c): Perubahan entalpi ketika satu mol suatu zat terbakar sempurna dalam oksigen berlebih dalam keadaan standar.
Faktor-faktor yang Mempengaruhi Perubahan Entalpi
Beberapa faktor dapat mempengaruhi perubahan entalpi suatu reaksi.
Suhu
Perubahan entalpi suatu reaksi umumnya bergantung pada suhu. Biasanya, perubahan entalpi dinyatakan pada suhu standar (298 K).
Tekanan
Perubahan entalpi juga dapat dipengaruhi oleh tekanan, terutama pada reaksi yang melibatkan gas. Namun, pengaruh tekanan biasanya lebih kecil dibandingkan dengan pengaruh suhu.
Wujud Zat
Wujud zat (padat, cair, atau gas) juga mempengaruhi perubahan entalpi. Perubahan wujud zat (misalnya, peleburan atau penguapan) juga melibatkan perubahan energi.
Contoh Soal dan Pembahasan Termokimia
Untuk memperdalam pemahaman Anda, mari kita lihat beberapa contoh soal dan pembahasannya.
Contoh Soal 1:
Diketahui entalpi pembentukan standar (ΔH°f) dari CO2(g) adalah -393.5 kJ/mol dan H2O(l) adalah -285.8 kJ/mol. Entalpi pembakaran standar (ΔH°c) dari CH4(g) adalah -890.4 kJ/mol. Hitunglah entalpi pembentukan standar (ΔH°f) dari CH4(g).
Pembahasan:
Reaksi pembakaran metana:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔH°c = -890.4 kJ/mol
ΔH°c = ΣΔH°f (produk) – ΣΔH°f (reaktan)
-890.4 = [ΔH°f (CO2) + 2ΔH°f (H2O)] – [ΔH°f (CH4) + 2ΔH°f (O2)]
Karena ΔH°f (O2) = 0 (unsur dalam keadaan standar)
-890.4 = [-393.5 + 2(-285.8)] – ΔH°f (CH4)
-890.4 = -393.5 – 571.6 – ΔH°f (CH4)
ΔH°f (CH4) = -393.5 – 571.6 + 890.4
ΔH°f (CH4) = -74.7 kJ/mol
Contoh Soal 2:
Sebanyak 50 mL larutan HCl 1 M direaksikan dengan 50 mL larutan NaOH 1 M dalam kalorimeter sederhana. Suhu awal kedua larutan adalah 25°C. Setelah reaksi, suhu campuran naik menjadi 31.5°C. Jika massa jenis larutan adalah 1 g/mL dan kalor jenis larutan adalah 4.18 J/g°C, hitunglah perubahan entalpi reaksi netralisasi tersebut.
Pembahasan:
q = mcΔT
m = (50 mL + 50 mL) x 1 g/mL = 100 g
c = 4.18 J/g°C
ΔT = 31.5°C – 25°C = 6.5°C
q = (100 g)(4.18 J/g°C)(6.5°C) = 2717 J = 2.717 kJ
Jumlah mol HCl = (50 mL)(1 M) = 0.05 mol
ΔH = -q/n = -2.717 kJ / 0.05 mol = -54.34 kJ/mol
Kesimpulan
Termokimia: studi perubahan energi dalam reaksi adalah bidang yang luas dan penting dalam kimia. Dari memahami mengapa es batu mendinginkan minuman hingga merancang mesin yang lebih efisien, prinsip-prinsip termokimia sangat relevan dalam kehidupan sehari-hari dan industri. Dengan memahami konsep-konsep dasar, metode pengukuran, dan faktor-faktor yang mempengaruhi perubahan entalpi, kita dapat memprediksi dan mengendalikan berbagai proses kimia dan fisika. Apakah Anda memiliki pengalaman menarik terkait termokimia? Mari berbagi di kolom komentar!
FAQ (Frequently Asked Questions)
1. Apa perbedaan antara entalpi dan energi internal?
Energi internal (U) adalah total energi yang dimiliki suatu sistem, termasuk energi kinetik dan energi potensial molekul-molekulnya. Entalpi (H) adalah fungsi keadaan yang menggambarkan kandungan panas sistem pada tekanan konstan, dan didefinisikan sebagai H = U + PV, di mana P adalah tekanan dan V adalah volume. Dalam banyak reaksi kimia yang terjadi pada tekanan atmosfer konstan, perubahan entalpi (ΔH) lebih mudah diukur daripada perubahan energi internal (ΔU).
2. Bagaimana cara menentukan apakah suatu reaksi eksoterm atau endoterm?
Reaksi eksoterm melepaskan panas ke lingkungan, sehingga suhu lingkungan naik dan ΔH < 0. Reaksi endoterm menyerap panas dari lingkungan, sehingga suhu lingkungan turun dan ΔH > 0. Anda dapat mengukur perubahan suhu lingkungan atau menggunakan data termokimia standar untuk menentukan apakah suatu reaksi eksoterm atau endoterm.
3. Mengapa entalpi pembentukan unsur dalam keadaan standar bernilai nol?
Entalpi pembentukan standar suatu unsur dalam keadaan standarnya (misalnya, O2(g), C(s, grafit), H2(g)) didefinisikan sebagai nol karena tidak ada perubahan energi yang diperlukan untuk membentuk unsur tersebut dari dirinya sendiri. Ini merupakan titik referensi untuk menghitung entalpi pembentukan senyawa lain.