Pernahkah kamu bertanya-tanya, kenapa ya es batu bisa mencair sendiri di suhu ruangan? Atau, kenapa proses pembakaran kayu menghasilkan panas? Nah, semua itu ada hubungannya dengan konsep penting dalam ilmu kimia yang disebut entalpi.
Entalpi ini seperti ‘rekening bank’ energi yang dimiliki suatu sistem kimia. Dalam artikel ini, kita akan menyelami lebih dalam tentang entalpi: konsep dasar energi dalam ilmu kimia, mulai dari definisi, jenis-jenisnya, hingga cara menghitungnya. Siap? Yuk, kita mulai!
Memahami Entalpi: Lebih dari Sekadar Panas
Entalpi (dilambangkan dengan H) adalah ukuran total energi termodinamika suatu sistem. Secara sederhana, entalpi bisa diartikan sebagai jumlah energi internal suatu sistem ditambah dengan hasil perkalian tekanan dan volume sistem tersebut. Agak rumit ya? Jangan khawatir!
Bayangkan begini: energi internal adalah semua energi yang ada di dalam suatu zat (energi kinetik molekul, energi potensial, dll.), sementara tekanan dan volume memberikan kontribusi tambahan terhadap energi total sistem.
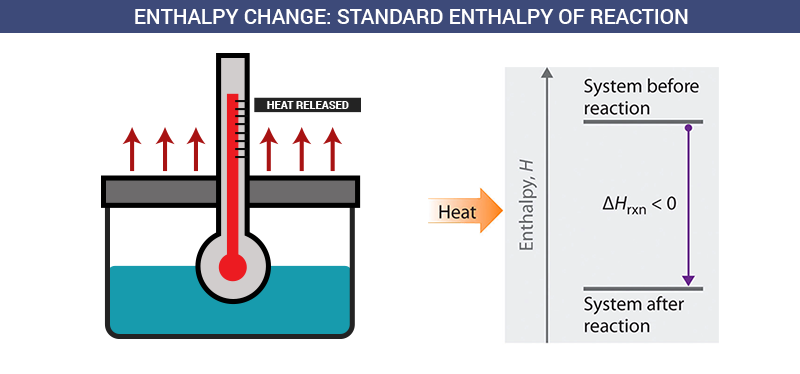
Entalpi sangat penting dalam kimia karena memungkinkan kita untuk memprediksi apakah suatu reaksi akan melepaskan panas (eksoterm) atau menyerap panas (endoterm). Perubahan entalpi (ΔH) adalah yang paling sering kita ukur dan gunakan dalam perhitungan.
Mengapa Perubahan Entalpi Lebih Penting?
Kita tidak bisa mengukur entalpi absolut suatu sistem secara langsung. Jadi, kita lebih fokus pada perubahan entalpi (ΔH). ΔH ini menunjukkan seberapa banyak panas yang dilepaskan atau diserap selama reaksi kimia terjadi pada tekanan konstan.
ΔH = H(produk) – H(reaktan)
Rumus ini sederhana tapi powerful. Jika ΔH negatif, berarti reaksi melepaskan panas (eksoterm). Jika ΔH positif, berarti reaksi menyerap panas (endoterm).
Jenis-Jenis Entalpi yang Perlu Kamu Ketahui
Ada beberapa jenis entalpi yang sering digunakan dalam perhitungan kimia. Masing-masing memiliki definisi dan aplikasi spesifik.
Entalpi Pembentukan Standar (ΔHf°)
Entalpi pembentukan standar adalah perubahan entalpi ketika satu mol suatu senyawa dibentuk dari unsur-unsurnya dalam keadaan standarnya (298 K dan 1 atm).
Contoh:
- Pembentukan air (H₂O) dari hidrogen (H₂) dan oksigen (O₂) dalam keadaan standar.
- Nilai ΔHf° untuk unsur dalam bentuk paling stabilnya adalah nol. Misalnya, ΔHf° (O₂) = 0.
Entalpi Pembakaran Standar (ΔHc°)
Entalpi pembakaran standar adalah perubahan entalpi ketika satu mol suatu zat dibakar sempurna dengan oksigen berlebih dalam keadaan standar.
Contoh:
- Pembakaran metana (CH₄) menghasilkan karbon dioksida (CO₂) dan air (H₂O).
- Reaksi pembakaran selalu eksoterm, sehingga ΔHc° selalu negatif.
Entalpi Pelarutan (ΔHsol)
Entalpi pelarutan adalah perubahan entalpi ketika satu mol zat terlarut dalam sejumlah pelarut tertentu.
Contoh:
- Pelarutan garam dapur (NaCl) dalam air.
- ΔHsol bisa positif (endoterm) atau negatif (eksoterm), tergantung pada zat terlarut dan pelarutnya.
Entalpi Netralisasi (ΔHnet)
Entalpi netralisasi adalah perubahan entalpi ketika satu mol asam bereaksi dengan satu mol basa membentuk satu mol air.
Contoh:
- Reaksi antara asam kuat (misalnya, HCl) dan basa kuat (misalnya, NaOH).
- Reaksi netralisasi umumnya eksoterm.
Hukum Hess: Mempermudah Perhitungan Entalpi
Hukum Hess menyatakan bahwa perubahan entalpi suatu reaksi hanya bergantung pada keadaan awal (reaktan) dan keadaan akhir (produk), dan tidak bergantung pada jalur reaksi.
Dengan kata lain, jika suatu reaksi dapat dipecah menjadi beberapa tahap, maka perubahan entalpi total reaksi adalah jumlah perubahan entalpi untuk setiap tahap.
Hukum Hess ini sangat berguna untuk menghitung perubahan entalpi reaksi yang sulit diukur secara langsung. Kita bisa menggunakan data entalpi pembentukan standar atau entalpi reaksi lainnya untuk menghitung ΔH reaksi yang diinginkan.
Aplikasi Hukum Hess
Misalnya, kita ingin menghitung perubahan entalpi untuk reaksi:
C (s) + ½ O₂ (g) → CO (g)
Reaksi ini sulit diukur secara langsung. Tapi, kita tahu data entalpi pembakaran untuk karbon (C) dan karbon monoksida (CO):
- C (s) + O₂ (g) → CO₂ (g) ΔH₁ = -393.5 kJ/mol
- CO (g) + ½ O₂ (g) → CO₂ (g) ΔH₂ = -283.0 kJ/mol
Dengan membalikkan reaksi kedua dan menjumlahkannya dengan reaksi pertama, kita bisa mendapatkan reaksi yang kita inginkan:
- C (s) + O₂ (g) → CO₂ (g) ΔH₁ = -393.5 kJ/mol
- CO₂ (g) → CO (g) + ½ O₂ (g) -ΔH₂ = +283.0 kJ/mol
C (s) + ½ O₂ (g) → CO (g) ΔH = ΔH₁ – ΔH₂ = -110.5 kJ/mol
Cara Menghitung Perubahan Entalpi
Ada beberapa cara untuk menghitung perubahan entalpi suatu reaksi:
-
Menggunakan Data Entalpi Pembentukan Standar (ΔHf°)
ΔH reaksi = Σ ΔHf°(produk) – Σ ΔHf°(reaktan)
Kita perlu tahu nilai ΔHf° untuk semua reaktan dan produk. Data ini biasanya tersedia dalam tabel termodinamika.
-
Menggunakan Hukum Hess
Seperti yang sudah dijelaskan di atas, kita bisa memanipulasi beberapa reaksi yang sudah diketahui ΔH-nya untuk mendapatkan reaksi yang kita inginkan.
-
Menggunakan Kalorimetri
Kalorimetri adalah teknik eksperimen untuk mengukur perubahan panas yang terjadi selama reaksi kimia. Kita menggunakan kalorimeter untuk mengukur perubahan suhu, dan kemudian menghitung perubahan entalpi menggunakan rumus:
q = m c ΔT
Dimana:
- q = panas yang diserap atau dilepaskan
- m = massa zat
- c = kalor jenis zat
- ΔT = perubahan suhu
Contoh Soal dan Pembahasan
Soal:
Hitunglah perubahan entalpi untuk reaksi pembakaran metana (CH₄):
CH₄ (g) + 2O₂ (g) → CO₂ (g) + 2H₂O (g)
Diketahui:
ΔHf° (CH₄) = -74.8 kJ/mol
ΔHf° (CO₂) = -393.5 kJ/mol
ΔHf° (H₂O) = -241.8 kJ/mol
Pembahasan:
Menggunakan rumus:
ΔH reaksi = Σ ΔHf°(produk) – Σ ΔHf°(reaktan)
ΔH reaksi = [ΔHf° (CO₂) + 2 ΔHf° (H₂O)] – [ΔHf° (CH₄) + 2 ΔHf° (O₂)]
Karena ΔHf° (O₂) = 0, maka:
ΔH reaksi = [-393.5 + 2 * (-241.8)] – [-74.8 + 0]
ΔH reaksi = -802.3 + 74.8
ΔH reaksi = -727.5 kJ/mol
Jadi, perubahan entalpi untuk reaksi pembakaran metana adalah -727.5 kJ/mol. Reaksi ini eksoterm, yang berarti melepaskan panas.
Pentingnya Memahami Entalpi dalam Kehidupan Sehari-hari
Memahami konsep entalpi bukan hanya penting dalam pelajaran kimia, tapi juga relevan dalam kehidupan sehari-hari.
- Energi: Kita bisa memahami bagaimana energi dihasilkan dari pembakaran bahan bakar, seperti gas alam atau bensin.
- Makanan: Kita bisa memahami mengapa makanan tertentu memberikan lebih banyak energi daripada makanan lain.
- Lingkungan: Kita bisa memahami dampak pembakaran bahan bakar fosil terhadap perubahan iklim.
Kesimpulan
Entalpi adalah konsep fundamental dalam ilmu kimia yang memungkinkan kita untuk memahami dan memprediksi perubahan energi dalam reaksi kimia. Memahami jenis-jenis entalpi, Hukum Hess, dan cara menghitung perubahan entalpi sangat penting untuk mengaplikasikan konsep ini dalam berbagai bidang.
Semoga artikel ini membantumu memahami entalpi: konsep dasar energi dalam ilmu kimia dengan lebih baik. Jika kamu punya pertanyaan atau pengalaman menarik tentang entalpi, jangan ragu untuk berbagi di kolom komentar!
FAQ (Frequently Asked Questions)
1. Apa perbedaan antara entalpi dan energi internal?
Entalpi (H) adalah energi internal (U) ditambah hasil perkalian tekanan (P) dan volume (V): H = U + PV. Energi internal adalah total energi yang ada di dalam suatu zat, sedangkan entalpi mempertimbangkan kontribusi tekanan dan volume terhadap energi total sistem.
2. Mengapa perubahan entalpi (ΔH) bisa positif atau negatif?
Perubahan entalpi (ΔH) positif menunjukkan bahwa reaksi menyerap panas dari lingkungan (endoterm), sehingga energi produk lebih tinggi dari energi reaktan. Sebaliknya, ΔH negatif menunjukkan bahwa reaksi melepaskan panas ke lingkungan (eksoterm), sehingga energi produk lebih rendah dari energi reaktan.
3. Bagaimana cara menggunakan Hukum Hess untuk menghitung perubahan entalpi?
Hukum Hess menyatakan bahwa perubahan entalpi suatu reaksi hanya bergantung pada keadaan awal dan akhir, tidak bergantung pada jalur reaksi. Kita bisa memanipulasi beberapa reaksi yang sudah diketahui ΔH-nya (membalikkan, mengalikan dengan koefisien) dan menjumlahkannya untuk mendapatkan reaksi yang kita inginkan. Perubahan entalpi reaksi yang diinginkan adalah jumlah perubahan entalpi reaksi-reaksi yang dimanipulasi.