Pernah nggak sih kamu bingung, kok ada sabun yang bikin kulit kering banget, tapi ada juga yang lembut? Atau kenapa ada cairan pembersih yang ampuh banget ngilangin noda membandel, tapi ada juga yang kurang nendang? Salah satu jawabannya mungkin terletak pada tingkat keasaman atau kebasaan cairan tersebut. Nah, kali ini kita bakal kupas tuntas perbedaan asam lemah dan asam kuat yang sering bikin pusing kepala! Siap jadi lebih paham tentang kimia sehari-hari? Yuk, simak!
Memahami Dasar Asam: Kuat vs. Lemah
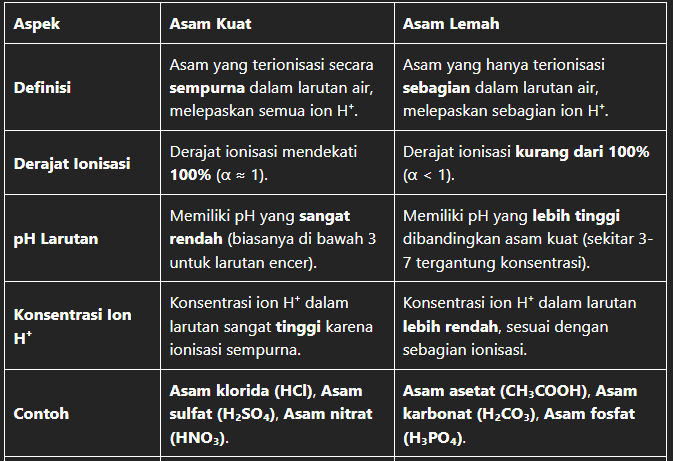
Sebelum kita masuk lebih dalam ke perbedaan yang spesifik, penting untuk memahami dulu apa itu asam. Secara sederhana, asam adalah zat yang melepaskan ion hidrogen (H+) ketika dilarutkan dalam air. Tingkat keasaman suatu larutan diukur dengan skala pH, dari 0 hingga 14. Angka di bawah 7 menunjukkan asam, 7 netral, dan di atas 7 basa.
Apa Itu Asam Kuat?
Asam kuat adalah asam yang terionisasi (terurai menjadi ion-ionnya) hampir sempurna dalam air. Artinya, hampir semua molekul asam kuat akan melepaskan ion H+ ke dalam larutan.
- Contoh Asam Kuat: Asam klorida (HCl), asam sulfat (H2SO4), asam nitrat (HNO3)
Apa Itu Asam Lemah?
Berbeda dengan asam kuat, asam lemah hanya terionisasi sebagian dalam air. Sebagian besar molekul asam lemah tetap utuh dalam larutan, dan hanya sebagian kecil yang melepaskan ion H+.
- Contoh Asam Lemah: Asam asetat (CH3COOH) – cuka, asam format (HCOOH), asam karbonat (H2CO3)
Perbedaan Utama Asam Lemah dan Asam Kuat yang Harus Dipahami
Sekarang, mari kita bahas perbedaan mendasar antara asam lemah dan asam kuat:
1. Tingkat Ionisasi
Ini adalah perbedaan paling krusial. Asam kuat terionisasi hampir 100%, sementara asam lemah hanya terionisasi sebagian kecil.
2. Kekuatan Asam (pH)
Asam kuat memiliki pH yang lebih rendah (lebih mendekati 0) dibandingkan asam lemah dengan konsentrasi yang sama. Semakin rendah pH, semakin asam larutan tersebut.
3. Konduktivitas Listrik
Larutan asam kuat menghantarkan listrik lebih baik daripada larutan asam lemah dengan konsentrasi yang sama. Hal ini karena asam kuat menghasilkan lebih banyak ion dalam larutan, yang berperan sebagai pembawa muatan listrik.
4. Reaksi dengan Logam
Asam kuat cenderung bereaksi lebih cepat dan lebih hebat dengan logam dibandingkan asam lemah. Reaksi ini menghasilkan gas hidrogen (H2) dan garam logam.
5. Reaksi dengan Basa
Baik asam kuat maupun asam lemah dapat menetralkan basa. Namun, reaksi asam kuat dengan basa biasanya lebih eksotermik (melepaskan panas) dibandingkan reaksi asam lemah dengan basa.
6. Konstanta Disosiasi Asam (Ka)
Asam lemah memiliki konstanta disosiasi asam (Ka) yang lebih kecil dibandingkan asam kuat. Ka adalah ukuran seberapa besar asam lemah terionisasi dalam air. Semakin kecil Ka, semakin lemah asam tersebut.
Contoh Penerapan Asam Kuat dan Asam Lemah dalam Kehidupan Sehari-hari
Pemahaman tentang perbedaan asam lemah dan asam kuat penting karena asam digunakan dalam berbagai aspek kehidupan kita.
Asam Kuat: Aplikasi Industri dan Pembersihan
Asam kuat sering digunakan dalam industri untuk berbagai keperluan, seperti:
- Produksi Pupuk: Asam sulfat (H2SO4) digunakan dalam produksi pupuk fosfat.
- Pembuatan Baja: Asam klorida (HCl) digunakan untuk membersihkan karat dari permukaan baja.
- Baterai Mobil: Asam sulfat juga merupakan komponen penting dalam baterai mobil.
- Pembersih Toilet: Asam klorida sering digunakan dalam pembersih toilet untuk menghilangkan noda membandel. (Hati-hati saat menggunakan!)
Asam Lemah: Makanan, Minuman, dan Kesehatan
Asam lemah banyak ditemukan dalam makanan, minuman, dan produk kesehatan:
- Cuka (Asam Asetat): Digunakan sebagai bumbu masakan dan pengawet makanan.
- Jus Lemon (Asam Sitrat): Memberikan rasa asam pada minuman dan makanan.
- Minuman Bersoda (Asam Karbonat): Memberikan efek berkarbonasi pada minuman.
- Obat-obatan: Beberapa obat-obatan mengandung asam lemah untuk membantu penyerapan dalam tubuh.
- Vitamin C (Asam Askorbat): Penting untuk kesehatan tubuh dan daya tahan.
Mengapa Memahami Perbedaan Ini Penting?
Memahami perbedaan asam lemah dan asam kuat penting karena beberapa alasan:
- Keamanan: Mengetahui kekuatan asam membantu kita menggunakan bahan kimia dengan aman dan menghindari bahaya.
- Efektivitas: Memilih asam yang tepat untuk tugas tertentu, misalnya memilih cuka untuk membersihkan noda ringan daripada asam klorida.
- Kesehatan: Memahami peran asam dalam makanan dan minuman membantu kita membuat pilihan makanan yang lebih sehat.
- Lingkungan: Mengetahui dampak asam terhadap lingkungan membantu kita mengelola limbah kimia dengan benar.
Tips Aman Menggunakan Asam
Baik asam kuat maupun asam lemah, keduanya tetaplah zat kimia yang perlu ditangani dengan hati-hati. Berikut beberapa tips aman:
- Selalu baca label: Perhatikan instruksi penggunaan dan peringatan yang tertera pada label produk.
- Gunakan alat pelindung diri (APD): Kenakan sarung tangan, kacamata pelindung, dan masker saat menggunakan asam.
- Ventilasi yang baik: Pastikan ruangan memiliki ventilasi yang baik saat menggunakan asam untuk menghindari menghirup uap berbahaya.
- Jangan mencampur asam dengan bahan kimia lain: Mencampur asam dengan bahan kimia tertentu dapat menghasilkan reaksi berbahaya.
- Simpan asam di tempat yang aman: Jauhkan asam dari jangkauan anak-anak dan hewan peliharaan.
- Buang limbah asam dengan benar: Ikuti peraturan setempat tentang pembuangan limbah kimia.
Kesimpulan
Memahami perbedaan asam lemah dan asam kuat membuka wawasan kita tentang kimia di sekitar kita. Asam kuat, dengan ionisasi yang hampir sempurna, memiliki aplikasi penting dalam industri dan pembersihan, sementara asam lemah, dengan ionisasi parsial, banyak kita temukan dalam makanan, minuman, dan produk kesehatan. Dengan memahami perbedaan ini, kita dapat menggunakan asam dengan lebih aman, efektif, dan bertanggung jawab. Gimana, sekarang jadi lebih paham kan tentang asam? Jangan ragu untuk berbagi pengalamanmu atau bertanya jika masih ada yang bikin penasaran!
FAQ (Frequently Asked Questions)
1. Bagaimana cara membedakan asam kuat dan asam lemah di laboratorium?
Di laboratorium, kita dapat menggunakan beberapa cara untuk membedakan asam kuat dan asam lemah:
- Mengukur pH: Asam kuat akan memberikan pH yang lebih rendah dibandingkan asam lemah dengan konsentrasi yang sama.
- Mengukur konduktivitas listrik: Larutan asam kuat akan menghantarkan listrik lebih baik daripada larutan asam lemah dengan konsentrasi yang sama.
- Menggunakan indikator pH: Indikator pH akan memberikan warna yang berbeda tergantung pada kekuatan asam.
- Melakukan titrasi: Titrasi dengan basa kuat dapat digunakan untuk menentukan konsentrasi asam dan memperkirakan kekuatan asam.
2. Apakah semua asam kuat berbahaya?
Ya, semua asam kuat berpotensi berbahaya karena sifat korosifnya. Namun, tingkat bahayanya tergantung pada konsentrasi dan cara penanganannya. Selalu gunakan alat pelindung diri (APD) dan ikuti instruksi keselamatan saat bekerja dengan asam kuat.
3. Apakah asam lemah aman dikonsumsi?
Beberapa asam lemah aman dikonsumsi dalam jumlah tertentu, seperti asam sitrat dalam jus lemon atau asam asetat dalam cuka. Namun, konsumsi asam lemah dalam jumlah berlebihan dapat menyebabkan masalah pencernaan atau kerusakan gigi.
4. Bisakah asam lemah menjadi asam kuat?
Tidak. Asam lemah tidak bisa "berubah" menjadi asam kuat. Kekuatan asam adalah sifat intrinsik dari molekul asam itu sendiri dan ditentukan oleh seberapa mudah ia melepaskan ion hidrogen (H+).
5. Apa saja contoh indikator alami untuk menguji keasaman?
Beberapa contoh indikator alami untuk menguji keasaman antara lain:
- Kubis merah: Air rebusan kubis merah akan berubah warna tergantung pada pH larutan.
- Bunga sepatu: Ekstrak bunga sepatu dapat digunakan sebagai indikator pH.
- Kunyit: Kunyit akan memberikan warna kuning pada larutan asam dan warna oranye pada larutan basa.
Semoga FAQ ini membantu menjawab pertanyaanmu! Jangan ragu untuk bertanya jika ada pertanyaan lain.