Pernahkah Anda bertanya-tanya bagaimana aluminium pada kaleng minuman Anda bisa terbentuk? Atau bagaimana baterai di ponsel Anda menyimpan energi? Jawabannya mungkin ada pada sebuah proses bernama elektrolisis. Elektrolisis bukan sekadar istilah kimia yang rumit, tapi merupakan proses penting yang mendasari banyak industri modern.
Artikel ini akan membongkar seluk-beluk elektrolisis, membahas definisinya, prinsip kerjanya, aplikasinya yang luas, hingga kelebihan dan kekurangannya. Bersiaplah untuk menyelami dunia kimia yang tak terduga dan mengungkap bagaimana elektrolisis: proses penting dalam industri modern ini membentuk kehidupan kita sehari-hari.
Apa Itu Elektrolisis? Definisi dan Konsep Dasar
Elektrolisis adalah proses kimia yang menggunakan arus listrik untuk menguraikan suatu senyawa menjadi unsur-unsur pembentuknya. Proses ini terjadi pada larutan elektrolit atau lelehan elektrolit.
Elektrolit sendiri adalah zat yang dapat menghantarkan listrik ketika dilarutkan dalam air atau dilelehkan. Contohnya adalah garam dapur (NaCl), asam sulfat (H2SO4), dan kalium hidroksida (KOH).
Bagaimana Elektrolisis Bekerja? Prinsip Dasar
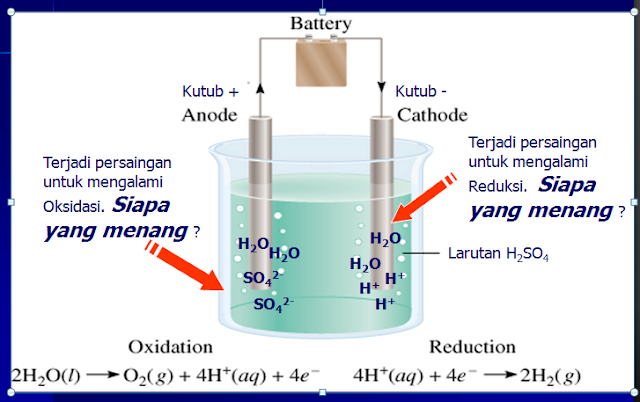
Elektrolisis bekerja dengan menggunakan dua elektroda: katoda (elektroda negatif) dan anoda (elektroda positif). Kedua elektroda ini dicelupkan ke dalam elektrolit dan dihubungkan ke sumber arus listrik.
Ketika arus listrik dialirkan, ion-ion positif (kation) dalam elektrolit akan tertarik ke katoda, tempat mereka menerima elektron (reduksi). Sebaliknya, ion-ion negatif (anion) akan tertarik ke anoda, tempat mereka melepaskan elektron (oksidasi).
Reaksi reduksi dan oksidasi ini akan menghasilkan produk-produk baru, seperti logam murni, gas, atau senyawa kimia lainnya.
Perbedaan Elektrolisis dengan Reaksi Kimia Spontan
Perbedaan utama antara elektrolisis dan reaksi kimia spontan adalah kebutuhan energi. Reaksi kimia spontan melepaskan energi (reaksi eksotermik), sedangkan elektrolisis membutuhkan energi dari sumber eksternal (reaksi endotermik).
Elektrolisis digunakan untuk memicu reaksi yang tidak akan terjadi secara alami, atau untuk menghasilkan produk yang sulit didapatkan melalui cara lain.
Komponen Utama dalam Proses Elektrolisis
Proses elektrolisis membutuhkan beberapa komponen penting agar dapat berjalan dengan efektif.
Elektrolit: Media Penghantar Listrik
Seperti yang telah dijelaskan sebelumnya, elektrolit adalah zat yang menghantarkan listrik ketika dilarutkan dalam air atau dilelehkan. Pemilihan elektrolit yang tepat sangat penting untuk keberhasilan proses elektrolisis.
Elektrolit yang baik harus memiliki konduktivitas listrik yang tinggi, tidak bereaksi dengan elektroda, dan menghasilkan produk yang diinginkan.
Elektroda: Tempat Terjadinya Reaksi
Elektroda adalah konduktor listrik yang berfungsi sebagai tempat terjadinya reaksi reduksi dan oksidasi. Terdapat dua jenis elektroda: katoda dan anoda.
Katoda terhubung ke terminal negatif sumber arus listrik dan menjadi tempat terjadinya reaksi reduksi. Anoda terhubung ke terminal positif sumber arus listrik dan menjadi tempat terjadinya reaksi oksidasi.
Material elektroda juga penting. Elektroda inert, seperti platina atau grafit, tidak ikut bereaksi dalam proses elektrolisis. Elektroda aktif, seperti tembaga atau nikel, dapat bereaksi dan mempengaruhi produk yang dihasilkan.
Sumber Arus Listrik: Pemicu Reaksi
Sumber arus listrik menyediakan energi yang dibutuhkan untuk menjalankan reaksi elektrolisis. Tegangan dan arus yang digunakan harus sesuai dengan jenis elektrolit dan reaksi yang diinginkan.
Sumber arus listrik yang umum digunakan adalah baterai, generator, atau rectifier (alat yang mengubah arus bolak-balik menjadi arus searah).
Penerapan Elektrolisis dalam Industri Modern
Elektrolisis: proses penting dalam industri modern memiliki berbagai aplikasi yang signifikan di berbagai bidang.
Produksi Logam Murni
Salah satu aplikasi utama elektrolisis adalah dalam produksi logam murni, seperti aluminium, tembaga, dan seng. Proses ini dikenal sebagai elektro-winning.
Bijih logam diubah menjadi larutan elektrolit, kemudian logam murni diendapkan di katoda melalui proses elektrolisis.
Elektro-Winning Aluminium
Proses Hall-Héroult menggunakan elektrolisis untuk menghasilkan aluminium dari alumina (Al2O3) yang dilarutkan dalam kriolit cair (Na3AlF6). Aluminium cair diendapkan di katoda, sementara oksigen dilepaskan di anoda.
Elektro-Winning Tembaga
Tembaga murni diperoleh dari tembaga yang tidak murni melalui proses elektrolisis. Tembaga yang tidak murni dijadikan anoda, dan tembaga murni diendapkan di katoda. Kotoran logam lainnya akan mengendap di dasar sel elektrolisis.
Pemurnian Logam
Elektrolisis juga digunakan untuk memurnikan logam yang sudah diekstraksi, seperti tembaga dan perak. Proses ini dikenal sebagai elektro-refining.
Logam yang tidak murni dijadikan anoda, dan logam murni diendapkan di katoda. Kotoran logam akan mengendap sebagai lumpur anoda.
Produksi Bahan Kimia
Elektrolisis digunakan untuk memproduksi berbagai bahan kimia penting, seperti klorin, natrium hidroksida (soda kaustik), dan hidrogen.
Proses Klor-Alkali
Proses klor-alkali menggunakan elektrolisis larutan garam dapur (NaCl) untuk menghasilkan klorin (Cl2), natrium hidroksida (NaOH), dan hidrogen (H2). Klorin digunakan sebagai disinfektan dan bahan baku industri kimia, natrium hidroksida digunakan dalam pembuatan sabun dan deterjen, dan hidrogen digunakan sebagai bahan bakar dan bahan baku industri.
Elektroplating: Pelapisan Logam
Elektroplating adalah proses pelapisan logam dengan lapisan logam lain menggunakan elektrolisis. Proses ini digunakan untuk meningkatkan penampilan, ketahanan korosi, atau sifat-sifat permukaan logam.
Contohnya adalah pelapisan krom pada baja untuk meningkatkan ketahanan korosi, atau pelapisan emas pada perhiasan untuk meningkatkan nilai estetika.
Produksi Hidrogen sebagai Bahan Bakar
Elektrolisis air (H2O) dapat digunakan untuk menghasilkan hidrogen (H2) dan oksigen (O2). Hidrogen dapat digunakan sebagai bahan bakar alternatif yang bersih, karena hanya menghasilkan air sebagai produk sampingan.
Proses ini dikenal sebagai elektrolisis air. Efisiensi elektrolisis air menjadi fokus penelitian untuk pengembangan energi terbarukan.
Kelebihan dan Kekurangan Elektrolisis
Seperti proses lainnya, elektrolisis memiliki kelebihan dan kekurangan yang perlu dipertimbangkan.
Kelebihan Elektrolisis
- Kemampuan menghasilkan produk dengan kemurnian tinggi: Elektrolisis dapat menghasilkan logam murni atau bahan kimia dengan tingkat kemurnian yang sulit dicapai dengan metode lain.
- Proses yang terkontrol: Kondisi elektrolisis, seperti tegangan, arus, dan suhu, dapat dikontrol untuk mengoptimalkan hasil dan kualitas produk.
- Aplikasi yang luas: Elektrolisis memiliki berbagai aplikasi di berbagai bidang industri, dari produksi logam hingga pembuatan bahan kimia.
- Potensi untuk energi terbarukan: Elektrolisis air dapat menggunakan energi terbarukan, seperti energi matahari atau angin, untuk menghasilkan hidrogen sebagai bahan bakar bersih.
Kekurangan Elektrolisis
- Membutuhkan energi yang besar: Elektrolisis adalah proses endotermik yang membutuhkan energi listrik untuk berlangsung. Biaya energi dapat menjadi faktor signifikan dalam biaya produksi.
- Potensi menghasilkan produk samping yang berbahaya: Dalam beberapa proses elektrolisis, dapat dihasilkan produk samping yang berbahaya, seperti klorin atau gas beracun lainnya. Perlu penanganan yang tepat untuk menghindari risiko.
- Membutuhkan peralatan yang mahal: Peralatan elektrolisis, seperti sel elektrolisis dan sumber arus listrik, dapat membutuhkan investasi yang besar.
- Korosi elektroda: Elektroda dapat mengalami korosi selama proses elektrolisis, terutama jika digunakan elektroda aktif. Perlu penggantian elektroda secara berkala.
Faktor-faktor yang Mempengaruhi Proses Elektrolisis
Efisiensi dan hasil elektrolisis dipengaruhi oleh beberapa faktor.
Jenis Elektrolit
Jenis elektrolit sangat mempengaruhi reaksi yang terjadi dan produk yang dihasilkan. Elektrolit yang berbeda akan menghasilkan ion yang berbeda, yang akan mempengaruhi potensial elektroda dan reaksi reduksi-oksidasi.
Konsentrasi Elektrolit
Konsentrasi elektrolit mempengaruhi konduktivitas listrik dan laju reaksi. Konsentrasi yang lebih tinggi biasanya meningkatkan konduktivitas dan laju reaksi, tetapi juga dapat menyebabkan masalah polarisasi.
Jenis Elektroda
Jenis elektroda mempengaruhi reaksi yang terjadi dan potensi elektroda. Elektroda inert tidak ikut bereaksi, sedangkan elektroda aktif dapat bereaksi dan mempengaruhi produk yang dihasilkan.
Suhu
Suhu mempengaruhi laju reaksi dan konduktivitas listrik. Suhu yang lebih tinggi biasanya meningkatkan laju reaksi dan konduktivitas, tetapi juga dapat menyebabkan masalah korosi dan dekomposisi elektrolit.
Arus Listrik
Arus listrik mempengaruhi laju reaksi dan jumlah produk yang dihasilkan. Arus yang lebih tinggi biasanya meningkatkan laju reaksi dan jumlah produk, tetapi juga dapat menyebabkan masalah polarisasi dan panas berlebih.
Kesimpulan
Elektrolisis: proses penting dalam industri modern adalah proses kimia yang sangat penting dan memiliki aplikasi yang luas. Dari produksi logam murni hingga pembuatan bahan kimia, elektrolisis berperan penting dalam berbagai industri modern. Meskipun memiliki beberapa kekurangan, seperti kebutuhan energi yang besar, kelebihan elektrolisis, seperti kemampuan menghasilkan produk dengan kemurnian tinggi dan potensi untuk energi terbarukan, menjadikannya teknologi yang penting untuk terus dikembangkan. Bagaimana pendapat Anda tentang potensi elektrolisis di masa depan? Apakah Anda memiliki pengalaman terkait dengan elektrolisis yang ingin dibagikan? Mari berdiskusi!
FAQ (Frequently Asked Questions)
Berikut adalah beberapa pertanyaan yang sering diajukan tentang elektrolisis:
1. Apa perbedaan antara elektrolisis dan elektroplating?
Elektrolisis adalah proses umum yang menggunakan arus listrik untuk menguraikan senyawa. Elektroplating adalah aplikasi khusus elektrolisis yang digunakan untuk melapisi logam dengan lapisan logam lain.
2. Apakah elektrolisis hanya bisa dilakukan dalam larutan?
Tidak, elektrolisis juga bisa dilakukan dalam lelehan elektrolit, seperti dalam proses Hall-Héroult untuk produksi aluminium.
3. Bagaimana cara meningkatkan efisiensi elektrolisis air?
Efisiensi elektrolisis air dapat ditingkatkan dengan menggunakan katalis yang lebih baik, meningkatkan suhu, atau menggunakan elektrolit yang lebih konduktif. Penelitian terus dilakukan untuk menemukan cara yang lebih efisien dan ekonomis untuk menghasilkan hidrogen melalui elektrolisis air.