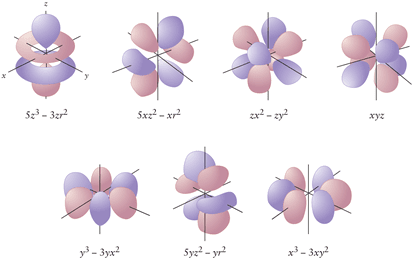
Pernahkah kamu membayangkan bagaimana atom yang begitu kecil bisa menyusun seluruh materi di alam semesta? Salah satu kunci untuk memahami rahasia ini terletak pada orbital, sebuah konsep penting dalam teori atom yang akan kita bahas tuntas kali ini.
Bayangkan elektron-elektron kecil mengelilingi inti atom. Tapi, elektron-elektron ini tidak bergerak sembarangan. Mereka menempati ruang-ruang tertentu yang disebut orbital. Yuk, kita selami lebih dalam tentang orbital: mengenal bentuk ruang elektron dalam teori atom dan mengapa pemahaman ini krusial dalam kimia!
Apa Itu Orbital?
Secara sederhana, orbital adalah daerah di sekitar inti atom di mana peluang terbesar untuk menemukan elektron berada. Jadi, bukan lintasan pasti seperti planet mengelilingi matahari, melainkan sebuah wilayah probabilitas.
Orbital ini memiliki bentuk dan energi yang berbeda-beda, ditentukan oleh bilangan kuantum. Bentuk orbital inilah yang akan sangat memengaruhi sifat-sifat kimia suatu atom dan molekul.
Bilangan Kuantum: Penentu Identitas Orbital
Sebelum membahas bentuk orbital, penting untuk memahami bilangan kuantum. Bilangan kuantum ini seperti kode unik yang mendeskripsikan setiap orbital. Ada empat jenis bilangan kuantum:
-
Bilangan Kuantum Utama (n): Menentukan tingkat energi utama orbital. Nilainya berupa bilangan bulat positif (1, 2, 3, dst.). Semakin besar nilai n, semakin tinggi tingkat energi dan semakin jauh orbital dari inti atom.
-
Bilangan Kuantum Azimuth atau Angular Momentum (l): Menentukan bentuk orbital. Nilainya berkisar dari 0 hingga n-1. Setiap nilai l mewakili bentuk orbital yang berbeda:
- l = 0: orbital s (bentuk bola)
- l = 1: orbital p (bentuk dumbbell)
- l = 2: orbital d (bentuk lebih kompleks)
- l = 3: orbital f (bentuk sangat kompleks)
-
Bilangan Kuantum Magnetik (ml): Menentukan orientasi orbital dalam ruang. Nilainya berkisar dari –l hingga +l, termasuk 0. Misalnya, untuk orbital p (l = 1), ml bisa bernilai -1, 0, atau +1, yang berarti ada tiga orientasi orbital p yang berbeda dalam ruang (px, py, pz).
-
Bilangan Kuantum Spin (ms): Menentukan spin elektron. Elektron dapat berputar (spin) searah jarum jam (spin up, ms = +1/2) atau berlawanan arah jarum jam (spin down, ms = -1/2). Setiap orbital hanya dapat ditempati oleh maksimal dua elektron dengan spin yang berlawanan (Prinsip Pauli).
Bentuk-Bentuk Orbital: Dari Bola Sederhana hingga Kompleks
Sekarang, mari kita fokus pada bentuk-bentuk orbital yang berbeda. Ingat, bentuk ini menunjukkan wilayah di mana elektron paling mungkin ditemukan.
Orbital s
- Bentuk: Bola simetris di sekitar inti atom.
- Jumlah: Hanya ada satu orbital s untuk setiap tingkat energi utama (n).
- Contoh: 1s, 2s, 3s, dst. Semakin tinggi nilai n, semakin besar ukuran orbital s.
- Karakteristik: Orbital s memiliki energi paling rendah dalam tingkat energi utama tertentu.
Orbital p
- Bentuk: Dumbbell atau halter.
- Jumlah: Ada tiga orbital p untuk setiap tingkat energi utama (n ≥ 2).
- Orientasi: Ketiga orbital p saling tegak lurus satu sama lain dan berorientasi sepanjang sumbu x, y, dan z (px, py, pz).
- Karakteristik: Orbital p memiliki simpul (node) di inti atom, yang berarti peluang menemukan elektron di inti atom adalah nol.
Orbital d
- Bentuk: Lebih kompleks daripada orbital s dan p. Sebagian besar orbital d memiliki empat lobus.
- Jumlah: Ada lima orbital d untuk setiap tingkat energi utama (n ≥ 3).
- Orientasi: Kelima orbital d memiliki orientasi yang berbeda dalam ruang.
- Karakteristik: Orbital d memiliki dua simpul angular.
Orbital f
- Bentuk: Sangat kompleks dan sulit divisualisasikan.
- Jumlah: Ada tujuh orbital f untuk setiap tingkat energi utama (n ≥ 4).
- Orientasi: Ketujuh orbital f memiliki orientasi yang berbeda dalam ruang.
- Karakteristik: Orbital f memiliki tiga simpul angular.
Konfigurasi Elektron: Mengisi Orbital dengan Benar
Setelah memahami bentuk orbital, kita perlu tahu bagaimana elektron-elektron ini mengisi orbital tersebut. Aturan pengisian orbital dikenal sebagai konfigurasi elektron. Ada beberapa prinsip yang perlu diperhatikan:
-
Prinsip Aufbau: Elektron mengisi orbital mulai dari tingkat energi terendah terlebih dahulu. Urutan pengisian orbital secara umum adalah: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
-
Aturan Hund: Dalam satu subkulit (misalnya, orbital p), elektron cenderung mengisi setiap orbital secara tunggal terlebih dahulu dengan spin yang sama sebelum berpasangan. Ini karena elektron dengan spin yang sama memiliki energi yang lebih rendah.
-
Prinsip Pauli: Tidak ada dua elektron dalam atom yang dapat memiliki keempat bilangan kuantum yang sama. Ini berarti setiap orbital hanya dapat ditempati oleh maksimal dua elektron dengan spin yang berlawanan.
Contoh Konfigurasi Elektron:
- Hidrogen (H): 1s¹ (satu elektron di orbital 1s)
- Helium (He): 1s² (dua elektron di orbital 1s)
- Lithium (Li): 1s² 2s¹ (dua elektron di orbital 1s dan satu elektron di orbital 2s)
- Oksigen (O): 1s² 2s² 2p⁴ (dua elektron di orbital 1s, dua elektron di orbital 2s, dan empat elektron di orbital 2p)
Mengapa Bentuk Orbital Penting?
Pemahaman tentang bentuk orbital sangat penting karena beberapa alasan:
-
Ikatan Kimia: Bentuk orbital menentukan bagaimana atom-atom berinteraksi untuk membentuk ikatan kimia. Overlap orbital antara atom-atom yang berbeda akan membentuk ikatan kovalen.
-
Sifat Molekul: Bentuk molekul dan sifat-sifatnya (seperti polaritas, reaktivitas, dan spektrum) sangat dipengaruhi oleh bentuk orbital atom-atom penyusunnya.
-
Spektroskopi: Transisi elektron antar orbital menghasilkan spektrum atom dan molekul yang dapat digunakan untuk mengidentifikasi dan menganalisis suatu zat.
-
Kimia Material: Bentuk orbital juga memainkan peran penting dalam sifat-sifat material, seperti konduktivitas listrik dan magnetisme.
Aplikasi Orbital dalam Kehidupan Sehari-hari
Meskipun terdengar abstrak, pemahaman tentang orbital memiliki aplikasi praktis yang luas dalam kehidupan sehari-hari:
-
Pengembangan Obat: Desain obat-obatan baru seringkali melibatkan pemodelan molekuler yang mempertimbangkan bentuk orbital untuk memastikan interaksi yang optimal dengan target biologis.
-
Energi Terbarukan: Dalam pengembangan sel surya, pemahaman tentang struktur elektronik dan orbital material semikonduktor sangat penting untuk meningkatkan efisiensi konversi energi.
-
Katalisis: Katalis digunakan untuk mempercepat reaksi kimia. Bentuk orbital katalis memengaruhi bagaimana ia berinteraksi dengan reaktan, sehingga memengaruhi laju dan selektivitas reaksi.
-
Teknologi Informasi: Dalam pengembangan perangkat elektronik, pemahaman tentang sifat-sifat material pada tingkat atom dan molekul (termasuk bentuk orbital) sangat penting untuk menciptakan perangkat yang lebih kecil, lebih cepat, dan lebih efisien.
Kesimpulan
Memahami konsep orbital: mengenal bentuk ruang elektron dalam teori atom adalah kunci untuk memahami dunia kimia. Bentuk orbital, yang ditentukan oleh bilangan kuantum, memengaruhi sifat-sifat atom, molekul, dan material. Dari ikatan kimia hingga pengembangan obat, pemahaman ini memiliki aplikasi yang luas dalam berbagai bidang.
Semoga artikel ini membantumu memahami konsep orbital dengan lebih baik. Bagaimana pendapatmu? Apakah ada aspek lain dari teori atom yang ingin kamu pelajari lebih lanjut? Mari berdiskusi!
FAQ (Frequently Asked Questions)
1. Apa perbedaan antara orbital dan orbit?
Orbit adalah lintasan pasti elektron mengelilingi inti atom (seperti model Bohr). Orbital, di sisi lain, adalah daerah di sekitar inti atom di mana peluang terbesar untuk menemukan elektron berada. Orbital merupakan konsep yang lebih akurat dan sesuai dengan mekanika kuantum.
2. Mengapa orbital memiliki bentuk yang berbeda?
Bentuk orbital ditentukan oleh bilangan kuantum azimuth (l). Setiap nilai l mewakili bentuk orbital yang berbeda: s (bola), p (dumbbell), d (lebih kompleks), dan f (sangat kompleks).
3. Berapa jumlah maksimum elektron yang dapat menempati suatu orbital?
Setiap orbital hanya dapat ditempati oleh maksimal dua elektron dengan spin yang berlawanan (Prinsip Pauli).