Pernahkah Anda melihat apel yang dipotong berubah warna menjadi cokelat? Atau mungkin Anda pernah mengamati karat pada pagar besi? Tanpa Anda sadari, fenomena sehari-hari ini melibatkan proses kimia yang sangat penting, yaitu reaksi redoks. Tapi, apa sebenarnya reaksi redoks itu? Jangan khawatir, kita akan membahasnya secara mendalam!
Dalam artikel ini, kita akan mengupas tuntas reaksi redoks: mulai dari contoh sederhana, rumus yang mendasarinya, hingga penerapannya dalam kehidupan sehari-hari. Dijamin setelah membaca ini, Anda akan lebih memahami kimia di sekitar Anda!
Memahami Dasar Reaksi Redoks
Apa itu reaksi redoks? Sederhananya, reaksi redoks adalah reaksi kimia yang melibatkan transfer elektron. Ada dua proses penting dalam reaksi ini: reduksi dan oksidasi.
Oksidasi: Kehilangan Elektron
Oksidasi adalah proses pelepasan elektron oleh suatu zat. Zat yang mengalami oksidasi disebut reduktor karena zat tersebut mereduksi zat lain. Bayangkan seorang teman yang rela memberikan pinjaman. Dia adalah reduktor karena dia membantu (mereduksi) kesulitan teman lainnya.
Reduksi: Mendapatkan Elektron
Reduksi adalah proses penangkapan elektron oleh suatu zat. Zat yang mengalami reduksi disebut oksidator karena zat tersebut mengoksidasi zat lain. Analogi yang sama, teman yang menerima pinjaman adalah oksidator karena dia menerima bantuan (oksidasi) dari temannya.
Mengapa Harus Ada Reduksi dan Oksidasi Bersamaan?
Ingat, elektron tidak bisa hilang begitu saja. Elektron yang dilepaskan oleh zat yang mengalami oksidasi harus diterima oleh zat lain yang mengalami reduksi. Itulah mengapa reaksi oksidasi dan reduksi selalu terjadi secara bersamaan. Keduanya seperti dua sisi mata uang yang tidak bisa dipisahkan.
Contoh Reaksi Redoks Sederhana
Mari kita lihat contoh reaksi redoks yang paling umum: pembakaran. Pembakaran adalah reaksi antara suatu bahan dengan oksigen yang menghasilkan panas dan cahaya.
Pembakaran Metana (CH4)
Reaksi pembakaran metana (CH4), gas alam yang sering digunakan untuk memasak, adalah contoh reaksi redoks:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Dalam reaksi ini:
- Metana (CH4) mengalami oksidasi karena karbon (C) kehilangan elektron dan berikatan dengan oksigen.
- Oksigen (O2) mengalami reduksi karena oksigen mendapatkan elektron dan berikatan dengan karbon dan hidrogen.
Pembentukan Karat (Fe2O3)
Karat pada besi (Fe) juga merupakan contoh reaksi redoks:
4Fe(s) + 3O2(g) → 2Fe2O3(s)
Dalam reaksi ini:
- Besi (Fe) mengalami oksidasi karena kehilangan elektron dan membentuk ion besi (Fe3+).
- Oksigen (O2) mengalami reduksi karena mendapatkan elektron dan membentuk ion oksida (O2-).
Bilangan Oksidasi: Menentukan Oksidasi dan Reduksi
Bilangan oksidasi adalah bilangan yang menunjukkan muatan suatu atom dalam suatu senyawa, jika semua ikatan ioniknya dianggap sempurna. Bilangan oksidasi membantu kita menentukan apakah suatu zat mengalami oksidasi atau reduksi.
Aturan Penentuan Bilangan Oksidasi
Ada beberapa aturan yang perlu diingat dalam menentukan bilangan oksidasi:
- Bilangan oksidasi unsur bebas (misalnya, Na, Fe, O2) adalah 0.
- Bilangan oksidasi ion monoatomik sama dengan muatannya (misalnya, Na+ memiliki bilangan oksidasi +1, Cl- memiliki bilangan oksidasi -1).
- Bilangan oksidasi oksigen (O) biasanya -2, kecuali dalam peroksida (H2O2) di mana bilangan oksidasinya -1.
- Bilangan oksidasi hidrogen (H) biasanya +1, kecuali dalam hidrida logam (misalnya, NaH) di mana bilangan oksidasinya -1.
- Jumlah bilangan oksidasi semua atom dalam suatu senyawa netral adalah 0.
- Jumlah bilangan oksidasi semua atom dalam suatu ion poliatomik sama dengan muatan ion tersebut.
Contoh Penentuan Bilangan Oksidasi
Mari kita tentukan bilangan oksidasi mangan (Mn) dalam ion permanganat (MnO4-):
- Kita tahu bahwa bilangan oksidasi oksigen (O) adalah -2.
- Karena ada 4 atom oksigen, maka total bilangan oksidasi oksigen adalah -8.
- Muatan ion permanganat adalah -1.
- Maka, bilangan oksidasi mangan (Mn) dapat dihitung sebagai berikut: Mn + (-8) = -1.
- Sehingga, bilangan oksidasi Mn = +7.
Menggunakan Bilangan Oksidasi untuk Menentukan Oksidasi dan Reduksi
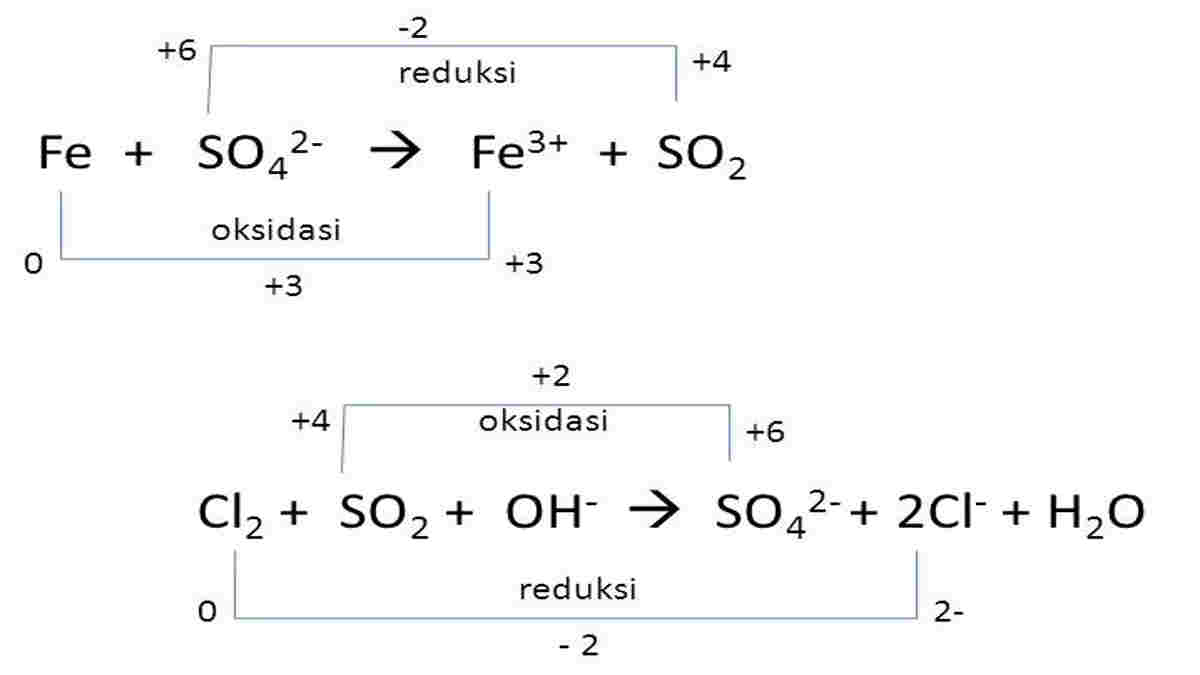
Jika bilangan oksidasi suatu atom meningkat dalam reaksi, maka atom tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasi suatu atom menurun dalam reaksi, maka atom tersebut mengalami reduksi.
Rumus Reaksi Redoks
Menuliskan persamaan reaksi redoks bisa jadi rumit, terutama untuk reaksi yang kompleks. Namun, ada beberapa metode yang bisa digunakan untuk menyeimbangkan persamaan reaksi redoks. Dua metode yang paling umum adalah metode setengah reaksi (metode ion elektron) dan metode bilangan oksidasi.
Metode Setengah Reaksi (Metode Ion Elektron)
Metode ini membagi reaksi redoks menjadi dua setengah reaksi: setengah reaksi oksidasi dan setengah reaksi reduksi. Setiap setengah reaksi kemudian diseimbangkan secara terpisah, dan kemudian kedua setengah reaksi digabungkan untuk mendapatkan persamaan reaksi redoks yang seimbang.
Langkah-langkah dalam metode setengah reaksi:
- Tuliskan kerangka persamaan reaksi.
- Pisahkan reaksi menjadi setengah reaksi oksidasi dan reduksi.
- Seimbangkan setiap setengah reaksi:
- Seimbangkan atom-atom selain oksigen (O) dan hidrogen (H).
- Seimbangkan atom oksigen dengan menambahkan molekul H2O.
- Seimbangkan atom hidrogen dengan menambahkan ion H+.
- Seimbangkan muatan dengan menambahkan elektron (e-).
- Samakan jumlah elektron yang dilepaskan dan diterima dalam kedua setengah reaksi.
- Jumlahkan kedua setengah reaksi untuk mendapatkan persamaan reaksi redoks yang seimbang.
- Jika reaksi terjadi dalam suasana basa, tambahkan ion OH- pada kedua sisi persamaan untuk menetralkan ion H+.
Metode Bilangan Oksidasi
Metode ini didasarkan pada perubahan bilangan oksidasi atom-atom yang terlibat dalam reaksi redoks.
Langkah-langkah dalam metode bilangan oksidasi:
- Tuliskan kerangka persamaan reaksi.
- Tentukan bilangan oksidasi setiap atom dalam reaksi.
- Identifikasi atom-atom yang mengalami oksidasi dan reduksi.
- Tentukan perubahan bilangan oksidasi untuk setiap atom yang mengalami oksidasi dan reduksi.
- Samakan perubahan bilangan oksidasi untuk oksidasi dan reduksi.
- Seimbangkan atom-atom selain oksigen (O) dan hidrogen (H).
- Seimbangkan atom oksigen dengan menambahkan molekul H2O.
- Seimbangkan atom hidrogen dengan menambahkan ion H+.
- Jika reaksi terjadi dalam suasana basa, tambahkan ion OH- pada kedua sisi persamaan untuk menetralkan ion H+.
Penerapan Reaksi Redoks di Kehidupan Sehari-hari
Reaksi redoks tidak hanya terjadi di laboratorium, tetapi juga memainkan peran penting dalam kehidupan sehari-hari.
Dalam Industri
- Produksi Logam: Reaksi redoks digunakan untuk mengekstrak logam dari bijihnya. Contohnya, ekstraksi besi dari bijih besi melibatkan reduksi besi oksida (Fe2O3) menjadi besi (Fe).
- Produksi Bahan Kimia: Banyak bahan kimia penting, seperti asam sulfat (H2SO4) dan amonia (NH3), diproduksi melalui reaksi redoks.
- Pengolahan Air: Reaksi redoks digunakan untuk menghilangkan polutan dari air, seperti logam berat dan bahan organik.
Dalam Energi
- Baterai: Baterai memanfaatkan reaksi redoks untuk menghasilkan listrik. Dalam baterai, terjadi reaksi oksidasi pada anoda (elektroda negatif) dan reaksi reduksi pada katoda (elektroda positif).
- Sel Bahan Bakar: Sel bahan bakar juga menggunakan reaksi redoks untuk menghasilkan listrik, tetapi dengan efisiensi yang lebih tinggi daripada baterai.
- Pembakaran Bahan Bakar: Seperti yang telah kita bahas sebelumnya, pembakaran bahan bakar adalah reaksi redoks yang menghasilkan energi panas dan cahaya.
Dalam Biologi
- Respirasi Seluler: Respirasi seluler adalah proses di mana sel menggunakan oksigen untuk mengoksidasi glukosa dan menghasilkan energi.
- Fotosintesis: Fotosintesis adalah proses di mana tumbuhan menggunakan energi matahari untuk mereduksi karbon dioksida menjadi glukosa.
- Enzim: Banyak enzim dalam tubuh bekerja dengan memanfaatkan reaksi redoks untuk mempercepat reaksi kimia.
Dalam Kehidupan Sehari-hari Lainnya
- Pemutihan: Bahan pemutih, seperti natrium hipoklorit (NaClO), bekerja dengan mengoksidasi pigmen pada noda, sehingga noda tersebut hilang.
- Antiseptik: Beberapa antiseptik, seperti hidrogen peroksida (H2O2), bekerja dengan mengoksidasi bakteri dan virus, sehingga membunuh mereka.
- Pencegahan Karat: Proses galvanisasi (melapisi besi dengan seng) melindungi besi dari karat karena seng lebih mudah teroksidasi daripada besi.
Kesimpulan
Reaksi redoks adalah fondasi dari banyak proses penting yang terjadi di sekitar kita, dari pembakaran bahan bakar hingga respirasi seluler. Memahami konsep dasar oksidasi, reduksi, dan bilangan oksidasi memungkinkan kita untuk memahami dan mengendalikan reaksi-reaksi ini. Dengan mempelajari reaksi redoks, kita dapat mengembangkan teknologi baru untuk menghasilkan energi yang lebih bersih, memproduksi bahan kimia yang lebih efisien, dan melindungi lingkungan. Bagaimana menurut Anda? Apakah ada penerapan reaksi redoks lain yang menarik perhatian Anda? Mari kita diskusikan!
FAQ (Frequently Asked Questions)
1. Apa perbedaan antara oksidasi dan reduksi?
Oksidasi adalah proses pelepasan elektron, sedangkan reduksi adalah proses penangkapan elektron. Dalam reaksi redoks, oksidasi dan reduksi selalu terjadi secara bersamaan.
2. Bagaimana cara menentukan apakah suatu zat mengalami oksidasi atau reduksi?
Anda dapat menentukan apakah suatu zat mengalami oksidasi atau reduksi dengan melihat perubahan bilangan oksidasinya. Jika bilangan oksidasinya meningkat, maka zat tersebut mengalami oksidasi. Jika bilangan oksidasinya menurun, maka zat tersebut mengalami reduksi.
3. Apa saja contoh penerapan reaksi redoks dalam kehidupan sehari-hari?
Contoh penerapan reaksi redoks dalam kehidupan sehari-hari termasuk pembakaran, pembentukan karat, produksi logam, baterai, respirasi seluler, fotosintesis, pemutihan, antiseptik, dan pencegahan karat.