Pernah gak sih kalian penasaran, kenapa ya dua zat kimia dicampur bisa langsung meledak, tapi ada juga yang cuma diem aja kayak gak terjadi apa-apa? Padahal kan sama-sama dicampur, ya kan? Nah, jawabannya ada di balik sesuatu yang disebut Teori Tumbukan: Penjelasan Mengapa Reaksi Bisa Terjadi.
Singkatnya, teori ini menjelaskan bahwa reaksi kimia itu terjadi karena partikel-partikel (atom, ion, atau molekul) saling bertumbukan. Tapi, tumbukan aja gak cukup. Ada syarat-syarat tertentu yang harus dipenuhi biar tumbukan itu beneran menghasilkan reaksi. Penasaran apa aja syaratnya? Yuk, kita bahas tuntas!
Apa Itu Teori Tumbukan?
Teori Tumbukan: Penjelasan Mengapa Reaksi Bisa Terjadi adalah fondasi utama dalam memahami kinetika kimia. Teori ini menjelaskan bahwa reaksi kimia hanya dapat terjadi ketika partikel reaktan bertumbukan satu sama lain.
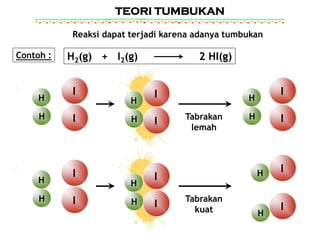
Namun, tidak semua tumbukan menghasilkan reaksi. Hanya tumbukan yang efektif, yaitu tumbukan dengan energi yang cukup dan orientasi yang tepat, yang akan menghasilkan produk.
Syarat Terjadinya Reaksi Berdasarkan Teori Tumbukan
Jadi, tumbukan aja gak cukup ya, guys! Ada dua syarat utama yang harus dipenuhi agar tumbukan itu efektif dan menghasilkan reaksi:
Energi Aktivasi yang Cukup
Bayangin kamu mau mendaki gunung. Butuh tenaga ekstra kan buat mencapai puncak? Nah, energi aktivasi ini ibarat tenaga ekstra itu.
Energi aktivasi adalah energi minimum yang dibutuhkan oleh partikel-partikel reaktan untuk memulai reaksi kimia. Kalau energi tumbukan kurang dari energi aktivasi, ya sama aja kayak mendaki gunung tapi gak punya tenaga, gak akan sampai puncak! Partikel-partikel cuma saling memantul tanpa menghasilkan apa-apa.
Orientasi Tumbukan yang Tepat
Selain energi yang cukup, orientasi tumbukan juga penting banget. Bayangin kamu mau buka pintu pakai kunci. Kalau kuncinya dimasukkan terbalik, ya gak akan kebuka kan?
Sama halnya dengan reaksi kimia. Partikel-partikel harus bertumbukan dengan orientasi yang tepat agar ikatan kimia yang lama bisa putus dan ikatan kimia yang baru bisa terbentuk. Kalau orientasinya salah, meskipun energinya cukup, reaksi tetap gak akan terjadi.
Faktor-Faktor yang Mempengaruhi Kecepatan Reaksi Berdasarkan Teori Tumbukan
Setelah kita tahu syarat-syarat terjadinya reaksi, sekarang kita bahas faktor-faktor apa aja sih yang bisa mempercepat atau memperlambat reaksi berdasarkan Teori Tumbukan: Penjelasan Mengapa Reaksi Bisa Terjadi?
Konsentrasi
Konsentrasi itu ibarat jumlah orang di dalam ruangan. Makin banyak orang, makin besar kemungkinan mereka saling bertumbukan kan?
Sama halnya dengan reaksi kimia. Semakin tinggi konsentrasi reaktan, semakin banyak partikel yang tersedia untuk bertumbukan. Akibatnya, frekuensi tumbukan meningkat dan reaksi berlangsung lebih cepat.
Suhu
Suhu itu ibarat energi yang diberikan ke partikel-partikel. Semakin tinggi suhu, semakin cepat partikel-partikel bergerak.
Dengan meningkatnya suhu, partikel-partikel memiliki energi kinetik yang lebih tinggi. Hal ini menyebabkan frekuensi tumbukan meningkat dan lebih banyak tumbukan yang memiliki energi yang cukup untuk mengatasi energi aktivasi. Jadi, reaksi berlangsung lebih cepat.
Luas Permukaan
Luas permukaan itu ibarat area yang tersedia untuk tumbukan. Bayangin kamu mau membakar kayu. Kalau kayunya besar dan utuh, akan lebih lambat terbakar dibandingkan kalau kayunya dipotong-potong kecil kan?
Semakin besar luas permukaan reaktan, semakin banyak area yang tersedia untuk tumbukan. Hal ini terutama penting untuk reaksi yang melibatkan zat padat. Semakin halus serbuk padatan, semakin cepat reaksinya.
Katalis
Katalis itu ibarat mak comblang dalam reaksi kimia. Dia membantu mempercepat reaksi tanpa ikut bereaksi.
Katalis bekerja dengan menurunkan energi aktivasi reaksi. Dengan energi aktivasi yang lebih rendah, lebih banyak tumbukan yang memiliki energi yang cukup untuk menghasilkan reaksi. Jadi, reaksi berlangsung lebih cepat. Katalis menyediakan jalur reaksi alternatif dengan energi aktivasi yang lebih rendah.
Contoh Penerapan Teori Tumbukan dalam Kehidupan Sehari-hari
Teori Tumbukan: Penjelasan Mengapa Reaksi Bisa Terjadi bukan cuma teori abstrak di buku pelajaran kimia lho! Teori ini banyak diterapkan dalam kehidupan sehari-hari, misalnya:
- Memasak: Memasak itu pada dasarnya adalah serangkaian reaksi kimia. Suhu yang tinggi mempercepat reaksi, sehingga makanan lebih cepat matang.
- Pembakaran: Pembakaran adalah reaksi kimia antara bahan bakar dan oksigen. Luas permukaan bahan bakar dan suhu lingkungan mempengaruhi kecepatan pembakaran.
- Industri Kimia: Industri kimia menggunakan teori tumbukan untuk mengoptimalkan kondisi reaksi, sehingga menghasilkan produk yang lebih banyak dan lebih cepat. Contohnya, pembuatan pupuk, obat-obatan, dan plastik.
- Penyimpanan Makanan: Menyimpan makanan di kulkas (suhu rendah) memperlambat reaksi pembusukan yang disebabkan oleh bakteri.
Mengapa Teori Tumbukan Penting?
Memahami Teori Tumbukan: Penjelasan Mengapa Reaksi Bisa Terjadi penting karena:
- Memprediksi Kecepatan Reaksi: Teori ini memungkinkan kita untuk memprediksi bagaimana perubahan kondisi (konsentrasi, suhu, luas permukaan, katalis) akan mempengaruhi kecepatan reaksi.
- Mengoptimalkan Reaksi Kimia: Teori ini membantu kita untuk mengoptimalkan kondisi reaksi agar reaksi berlangsung lebih cepat dan efisien.
- Memahami Mekanisme Reaksi: Teori ini memberikan wawasan tentang bagaimana reaksi kimia terjadi pada tingkat molekuler.
- Mengembangkan Teknologi Baru: Teori ini menjadi dasar untuk mengembangkan teknologi baru di berbagai bidang, seperti energi, material, dan kesehatan.
Batasan Teori Tumbukan
Meskipun sangat berguna, Teori Tumbukan: Penjelasan Mengapa Reaksi Bisa Terjadi memiliki beberapa batasan:
- Tidak Memperhitungkan Struktur Molekul: Teori ini menganggap partikel sebagai bola keras tanpa memperhitungkan struktur molekul yang kompleks.
- Tidak Menjelaskan Reaksi Kompleks: Teori ini lebih cocok untuk menjelaskan reaksi sederhana daripada reaksi kompleks yang melibatkan banyak tahapan.
- Tidak Memperhitungkan Efek Pelarut: Teori ini tidak memperhitungkan efek pelarut terhadap kecepatan reaksi.
- Tidak Sepenuhnya Akurat untuk Reaksi Fase Gas: Pada tekanan tinggi, asumsi tumbukan biner (dua partikel) tidak lagi valid.
Untuk mengatasi batasan ini, para ilmuwan mengembangkan teori yang lebih canggih, seperti Teori Keadaan Transisi (Transition State Theory).
Kesimpulan
Teori Tumbukan: Penjelasan Mengapa Reaksi Bisa Terjadi adalah konsep fundamental dalam kimia yang menjelaskan mengapa reaksi terjadi dan faktor-faktor apa saja yang mempengaruhinya. Memahami teori ini membantu kita memprediksi, mengoptimalkan, dan mengendalikan reaksi kimia dalam berbagai aplikasi. Meskipun memiliki beberapa batasan, teori ini tetap menjadi dasar yang kuat untuk memahami kinetika kimia.
Jadi, sekarang kalian sudah paham kan kenapa ada reaksi yang cepat dan ada yang lambat? Gimana, ada pengalaman menarik terkait reaksi kimia yang pengen kalian bagi? Yuk, diskusi di kolom komentar!
FAQ (Frequently Asked Questions)
1. Apa perbedaan antara tumbukan elastis dan tumbukan tidak elastis dalam konteks teori tumbukan?
Dalam tumbukan elastis, energi kinetik total sistem (reaktan) tetap sama setelah tumbukan. Partikel-partikel hanya saling memantul tanpa menghasilkan reaksi. Sementara itu, dalam tumbukan tidak elastis, sebagian energi kinetik diubah menjadi energi internal (vibrasi, rotasi) partikel. Tumbukan tidak elastis yang efektif (dengan energi dan orientasi yang tepat) dapat menghasilkan reaksi kimia.
2. Bagaimana cara meningkatkan frekuensi tumbukan dalam suatu reaksi?
Frekuensi tumbukan dapat ditingkatkan dengan beberapa cara:
- Meningkatkan Konsentrasi: Semakin banyak partikel, semakin besar kemungkinan tumbukan.
- Meningkatkan Suhu: Partikel bergerak lebih cepat pada suhu yang lebih tinggi, sehingga meningkatkan frekuensi tumbukan.
- Meningkatkan Luas Permukaan: Khusus untuk reaksi yang melibatkan zat padat, memperluas permukaan kontak akan meningkatkan frekuensi tumbukan.
3. Apakah semua katalis bekerja dengan menurunkan energi aktivasi?
Ya, secara umum, katalis bekerja dengan menurunkan energi aktivasi reaksi. Namun, mekanisme kerjanya bisa berbeda-beda. Beberapa katalis membentuk kompleks antara dengan reaktan, menyediakan jalur reaksi alternatif dengan energi aktivasi yang lebih rendah. Katalis lain dapat meningkatkan frekuensi tumbukan dengan mengorientasikan reaktan secara lebih efektif.