Pernah nggak sih, pas lagi masak, takaran bumbu nggak pas? Kebanyakan garam, kurang gula, alhasil masakan jadi kurang nikmat. Nah, dalam dunia kimia, ketelitian dalam mengukur larutan itu krusial banget. Salah ukur sedikit, hasilnya bisa beda jauh. Salah satu metode yang paling sering dipakai buat ngukur konsentrasi larutan dengan akurat adalah volumetri, khususnya dalam analisis asam basa.
Bayangin deh, kalau kita mau netralin keasaman tanah buat nanam tanaman tertentu. Kita harus tahu pasti berapa banyak basa yang harus kita tambahin. Di sinilah volumetri: metode analisis larutan asam basa berperan penting. Artikel ini bakal ngebahas tuntas tentang volumetri, mulai dari prinsip dasar sampai contoh penerapannya dalam kehidupan sehari-hari. Jadi, siap belajar bareng?
Mengenal Lebih Dalam Volumetri: Metode Analisis Larutan Asam Basa
Volumetri, atau titrasi, adalah teknik analisis kuantitatif yang digunakan untuk menentukan konsentrasi suatu zat (analit) dengan mereaksikan analit tersebut dengan larutan lain yang konsentrasinya sudah diketahui (titran). Intinya, kita "meneteskan" titran ke analit sampai reaksinya selesai. Dari volume titran yang kita pakai, kita bisa hitung konsentrasi analitnya.
Prinsip Dasar Volumetri
Prinsip dasar volumetri terletak pada reaksi kimia yang terjadi antara analit dan titran. Reaksi ini harus memenuhi beberapa syarat:
- Reaksi harus berlangsung cepat: Supaya kita nggak nunggu lama buat ngeliat hasilnya.
- Reaksi harus stoikiometri: Artinya, perbandingan mol antara analit dan titran harus jelas dan pasti. Misalnya, 1 mol asam bereaksi dengan 1 mol basa.
- Harus ada indikator yang jelas: Indikator ini akan memberi tahu kita kapan reaksi sudah selesai (titik akhir titrasi).
- Tidak ada reaksi samping: Supaya hasil yang kita dapat akurat.
Peralatan yang Dibutuhkan dalam Volumetri
Buat melakukan titrasi, kita butuh beberapa peralatan penting:
- Buret: Tabung gelas panjang dengan keran di bawahnya, digunakan untuk meneteskan titran secara perlahan dan akurat.
- Labu Erlenmeyer: Wadah berbentuk kerucut untuk menampung analit dan tempat terjadinya reaksi.
- Pipet volume: Digunakan untuk mengambil volume analit yang tepat.
- Indikator: Zat yang berubah warna pada titik akhir titrasi.
- Statif dan klem: Untuk menyangga buret agar tegak.
- Gelas kimia: Untuk membuat dan menyimpan larutan.
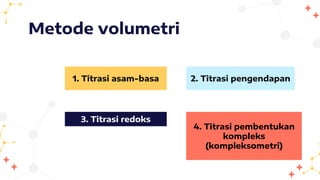
Jenis-Jenis Volumetri Berdasarkan Reaksi
Volumetri bisa dibedakan berdasarkan jenis reaksi yang terjadi antara analit dan titran. Beberapa jenis yang paling umum adalah:
- Asidimetri dan Alkalimetri: Ini adalah jenis volumetri yang paling sering digunakan. Asidimetri melibatkan titrasi basa dengan asam standar, sedangkan alkalimetri melibatkan titrasi asam dengan basa standar.
- Redoksmetri: Melibatkan reaksi reduksi dan oksidasi. Contohnya adalah permanganometri (menggunakan kalium permanganat sebagai titran) dan iodometri (menggunakan iodin sebagai titran).
- Argentometri: Melibatkan pembentukan endapan perak halida. Biasanya digunakan untuk menentukan kadar klorida, bromida, atau iodida.
- Kompleksometri: Melibatkan pembentukan kompleks antara ion logam dengan ligan (zat yang mengikat ion logam). Contohnya adalah titrasi EDTA (ethylenediaminetetraacetic acid) untuk menentukan kadar ion logam seperti kalsium dan magnesium.
Langkah-Langkah Melakukan Volumetri Asam Basa
Proses volumetri asam basa secara umum melibatkan beberapa langkah penting untuk memastikan hasil yang akurat dan presisi. Berikut adalah langkah-langkahnya:
- Persiapan Larutan Standar: Larutan standar adalah larutan yang konsentrasinya sudah diketahui dengan pasti. Larutan ini digunakan sebagai titran. Pembuatan larutan standar harus dilakukan dengan hati-hati dan teliti.
- Timbang sejumlah zat padat dengan berat yang tepat menggunakan neraca analitik.
- Larutkan zat padat tersebut dalam sejumlah volume pelarut yang tepat menggunakan labu ukur.
- Hitung konsentrasi larutan standar dengan menggunakan rumus yang sesuai.
- Persiapan Analit: Analit adalah zat yang akan ditentukan konsentrasinya. Analit harus dipersiapkan dengan benar sebelum dititrasi.
- Ambil sejumlah volume analit yang tepat menggunakan pipet volume.
- Masukkan analit ke dalam labu Erlenmeyer.
- Tambahkan beberapa tetes indikator yang sesuai.
- Proses Titrasi: Titrasi dilakukan dengan menambahkan titran secara perlahan ke dalam analit sambil terus diaduk.
- Isi buret dengan larutan standar (titran).
- Catat volume awal titran dalam buret.
- Teteskan titran secara perlahan ke dalam labu Erlenmeyer yang berisi analit sambil terus diaduk.
- Amati perubahan warna indikator.
- Hentikan titrasi ketika indikator menunjukkan perubahan warna yang signifikan (titik akhir titrasi).
- Catat volume akhir titran dalam buret.
- Perhitungan: Setelah titrasi selesai, hitung konsentrasi analit dengan menggunakan data yang diperoleh.
- Hitung volume titran yang digunakan dengan mengurangkan volume awal dari volume akhir.
- Gunakan persamaan stoikiometri reaksi untuk menghitung mol analit yang bereaksi dengan titran.
- Hitung konsentrasi analit dengan membagi mol analit dengan volume analit yang digunakan.
Memilih Indikator yang Tepat
Pemilihan indikator yang tepat sangat penting untuk keberhasilan volumetri. Indikator yang baik harus menunjukkan perubahan warna yang jelas dan tajam pada titik akhir titrasi.
- Trayek pH: Setiap indikator memiliki trayek pH tertentu di mana ia akan berubah warna. Pilih indikator yang trayek pH-nya sesuai dengan titik ekivalen reaksi. Titik ekivalen adalah titik di mana jumlah mol asam sama dengan jumlah mol basa.
- Perubahan Warna yang Jelas: Pilih indikator yang memberikan perubahan warna yang mudah diamati.
- Contoh Indikator: Beberapa indikator yang umum digunakan dalam titrasi asam basa antara lain:
- Fenolftalein: Berwarna tidak berwarna dalam larutan asam dan berwarna merah muda dalam larutan basa. Trayek pH-nya adalah 8.3 – 10.0.
- Metil Oranye: Berwarna merah dalam larutan asam dan berwarna kuning dalam larutan basa. Trayek pH-nya adalah 3.1 – 4.4.
- Bromtimol Biru: Berwarna kuning dalam larutan asam dan berwarna biru dalam larutan basa. Trayek pH-nya adalah 6.0 – 7.6.
Tips dan Trik untuk Titrasi yang Akurat
Berikut adalah beberapa tips dan trik untuk memastikan titrasi yang akurat:
- Gunakan peralatan yang bersih dan kering: Kontaminasi dapat mempengaruhi hasil titrasi.
- Pastikan larutan standar memiliki konsentrasi yang tepat: Kesalahan dalam pembuatan larutan standar akan mempengaruhi hasil titrasi.
- Lakukan titrasi secara perlahan dan hati-hati: Terlalu cepat meneteskan titran dapat menyebabkan terlewati titik akhir titrasi.
- Aduk larutan secara terus menerus selama titrasi: Untuk memastikan reaksi berlangsung sempurna.
- Amati perubahan warna indikator dengan seksama: Hentikan titrasi segera setelah indikator menunjukkan perubahan warna yang signifikan.
- Ulangi titrasi beberapa kali: Untuk mendapatkan hasil yang lebih akurat dan presisi.
- Perhatikan meniskus saat membaca volume buret: Baca volume pada bagian bawah meniskus untuk larutan yang tidak berwarna dan pada bagian atas meniskus untuk larutan yang berwarna.
Aplikasi Volumetri dalam Kehidupan Sehari-hari
Volumetri bukan cuma dipelajari di lab kimia aja, lho! Metode ini punya banyak aplikasi praktis dalam kehidupan sehari-hari:
- Industri Makanan dan Minuman: Menentukan kadar asam asetat dalam cuka, kadar vitamin C dalam jus buah, atau kadar garam dalam makanan olahan.
- Industri Farmasi: Menentukan kadar obat-obatan dalam tablet atau sirup.
- Pengolahan Air: Menentukan kadar klorida dalam air minum atau kadar kesadahan air.
- Pertanian: Menentukan kadar keasaman tanah untuk menentukan jenis pupuk yang tepat.
- Lingkungan: Menentukan kadar polutan dalam air atau udara.
Contoh Soal dan Pembahasan Volumetri
Biar makin paham, yuk kita coba bahas contoh soal volumetri:
Soal:
Sebanyak 25 mL larutan asam klorida (HCl) dititrasi dengan larutan natrium hidroksida (NaOH) 0,1 M. Titik akhir titrasi tercapai saat volume NaOH yang dibutuhkan adalah 20 mL. Hitunglah konsentrasi larutan HCl tersebut!
Pembahasan:
-
Tulis persamaan reaksi:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) -
Hitung mol NaOH yang digunakan:
Mol NaOH = Molaritas x Volume = 0,1 M x 0,02 L = 0,002 mol -
Karena perbandingan stoikiometri HCl dan NaOH adalah 1:1, maka mol HCl yang bereaksi juga 0,002 mol.
-
Hitung konsentrasi HCl:
Konsentrasi HCl = Mol HCl / Volume HCl = 0,002 mol / 0,025 L = 0,08 M
Jadi, konsentrasi larutan HCl tersebut adalah 0,08 M.
Kesimpulan
Volumetri: metode analisis larutan asam basa adalah teknik yang powerful buat menentukan konsentrasi suatu larutan dengan akurat. Mulai dari persiapan larutan standar, proses titrasi yang teliti, sampai perhitungan yang tepat, semua langkahnya penting buat dapetin hasil yang valid. Dengan memahami prinsip dasar dan aplikasi volumetri, kita bisa lebih appreciate betapa pentingnya ketelitian dalam dunia kimia dan kehidupan sehari-hari. Gimana, udah siap buat nyoba titrasi sendiri? Share pengalamanmu di kolom komentar, ya!
FAQ (Frequently Asked Questions)
1. Apa perbedaan antara titik akhir titrasi dan titik ekivalen?
Titik ekivalen adalah titik di mana jumlah mol asam sama dengan jumlah mol basa. Titik akhir titrasi adalah titik di mana indikator menunjukkan perubahan warna. Idealnya, titik akhir titrasi harus sedekat mungkin dengan titik ekivalen.
2. Apa yang menyebabkan kesalahan dalam titrasi?
Beberapa faktor yang dapat menyebabkan kesalahan dalam titrasi antara lain:
- Kesalahan dalam pembuatan larutan standar.
- Kesalahan dalam pengukuran volume.
- Kontaminasi larutan.
- Pemilihan indikator yang tidak tepat.
- Pengamatan titik akhir titrasi yang kurang tepat.
3. Bagaimana cara meningkatkan akurasi hasil titrasi?
Untuk meningkatkan akurasi hasil titrasi, pastikan untuk:
- Menggunakan peralatan yang bersih dan terkalibrasi.
- Membuat larutan standar dengan hati-hati dan teliti.
- Melakukan titrasi secara perlahan dan hati-hati.
- Menggunakan indikator yang tepat.
- Mengulangi titrasi beberapa kali.
- Memperhatikan meniskus saat membaca volume buret.